Le chlorate de magnésium (Mg(ClO3)2) est un composé composé d’ions Mg2+ et ClO3-. C’est une poudre cristalline blanche soluble dans l’eau et hautement réactive. Il peut être utilisé comme agent oxydant dans la production de feux d’artifice et comme désinfectant dans le traitement des eaux.
| Nom UICPA | Chlorate de magnésium |
| Formule moléculaire | Mg(ClO3)2 |
| Numero CAS | 10326-21-3 |
| Synonymes | Diperchlorate de magnésium, chlorate de magnésium(II), chlorate de magnésium hexahydraté |
| InChI | InChI=1S/2ClHO3.Mg/c2 2-1(3)4;/h2 (H,2,3,4);/q;;+2/p-2 |
Propriétés du chlorate de magnésium
Formule de chlorate de magnésium
Le chlorate de magnésium est un composé chimique de formule Mg(ClO3)2. Le composé est composé d’un ion magnésium (Mg2+) et de deux ions ClO3. La formule chimique indique qu’une molécule de chlorate de magnésium contient deux ions chlorure et six atomes d’oxygène.
Chlorate De Magnésium Masse molaire
La masse molaire de Mg(ClO3)2 est de 191,2 g/mol. Cette valeur est calculée en additionnant les poids atomiques des éléments présents dans une molécule de Mg(ClO3)2. Le magnésium a une masse molaire de 24,31 g/mol, tandis que le chlore et l’oxygène ont des masses molaires de 35,45 g/mol et 16,00 g/mol, respectivement. En multipliant la masse molaire de chaque élément par le nombre d’atomes de cet élément dans la molécule et en les additionnant, on obtient la masse molaire du composé.
Point d’ébullition du chlorate de magnésium
Mg(ClO3)2 se décompose avant d’atteindre son point d’ébullition. Lorsqu’il est chauffé, Mg(ClO3)2 se décompose en chlorure de magnésium, oxygène gazeux et chlore gazeux. Par conséquent, Mg(ClO3)2 n’a pas de point d’ébullition.
Chlorate de magnésium Point de fusion
Le point de fusion du Mg(ClO3)2 est de 105°C. À cette température, le composé solide se transforme en forme liquide. Le point de fusion du Mg(ClO3)2 peut varier en fonction de la pureté du composé et des conditions dans lesquelles il est mesuré.
Densité du chlorate de magnésium g/mL
La densité de Mg(ClO3)2 est de 2,21 g/mL. Cela signifie qu’un millilitre de Mg(ClO3)2 a une masse de 2,21 grammes. La densité de Mg(ClO3)2 peut être utilisée pour calculer le volume d’une masse donnée du composé ou la masse d’un volume donné du composé.
Chlorate De Magnésium Poids moléculaire
Le poids moléculaire du Mg(ClO3)2 est de 191,2 g/mol. Cette valeur est calculée en additionnant les poids atomiques des éléments présents dans une molécule de Mg(ClO3)2.
Structure du chlorate de magnésium
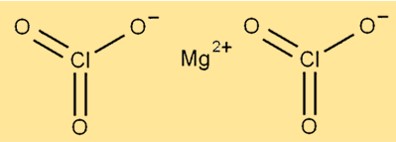
La structure du Mg(ClO3)2 est composée d’ions magnésium entourés de six atomes d’oxygène et de deux atomes de chlore. L’ion magnésium est situé au centre de la molécule, tandis que les atomes d’oxygène et de chlore sont disposés autour de lui. Le composé a une structure cristalline et est de couleur blanche.
Solubilité du chlorate de magnésium
Mg(ClO3)2 est soluble dans l’eau, l’éthanol et l’acétone. La solubilité du Mg(ClO3)2 dans l’eau augmente avec la température. À température ambiante, environ 31 grammes de Mg(ClO3)2 peuvent se dissoudre dans 100 ml d’eau. La solubilité du Mg(ClO3)2 dans d’autres solvants dépend de la polarité du solvant.
| Apparence | Poudre cristalline blanche |
| Gravité spécifique | 2,21 g/cm3 |
| Couleur | Blanc |
| Odeur | Inodore |
| Masse molaire | 191,2 g/mole |
| Densité | 2,21 g/ml |
| Point de fusion | 105°C |
| Point d’ébullition | Se décompose avant de bouillir |
| Point d’éclair | N’est pas applicable |
| Solubilité dans l’eau | Soluble |
| Solubilité | Soluble dans l’eau, l’éthanol et l’acétone |
| La pression de vapeur | N’est pas applicable |
| Densité de vapeur | N’est pas applicable |
| pKa | N’est pas applicable |
| pH | N’est pas applicable |
Sécurité et dangers du chlorate de magnésium
Le Mg(ClO3)2 est un agent oxydant puissant et peut réagir violemment avec des matériaux combustibles, provoquant des incendies ou des explosions. Il peut également provoquer une irritation de la peau, des yeux et du système respiratoire par contact ou par inhalation. Par conséquent, un équipement de protection individuelle approprié, tel que des gants et des lunettes, doit être utilisé lors de la manipulation de Mg(ClO3)2. Le composé doit également être stocké à l’écart des matériaux combustibles et des sources de chaleur ou d’ignition. De plus, une ventilation adéquate doit être assurée pour empêcher l’inhalation des poussières ou des vapeurs du composé. Le Mg(ClO3)2 doit être manipulé avec prudence pour éviter les dangers potentiels.
| Symboles de danger | Oxydant |
| Description de la sécurité | Évitez tout contact avec des matériaux combustibles, portez des gants et des lunettes de protection, assurez une ventilation adéquate |
| Numéros d’identification de l’ONU | UN1475 |
| Code SH | 2829.90.90 |
| Classe de danger | 5.1 |
| Groupe d’emballage | II |
| Toxicité | Peut provoquer une irritation de la peau, des yeux et des voies respiratoires ; peut être nocif en cas d’ingestion |
Méthodes de synthèse du chlorate de magnésium
On peut utiliser différentes méthodes pour synthétiser Mg(ClO3)2.
Une méthode courante consiste à faire réagir l’hydroxyde de magnésium avec de l’acide chlorique. La réaction se déroule comme suit :
Mg(OH)2 + 2HClO3 → Mg(ClO3)2 + 2H2O
Une autre méthode consiste à faire réagir le carbonate de magnésium avec de l’acide perchlorique. La réaction se déroule comme suit :
MgCO3 + 2HClO4 → Mg(ClO4)2 + CO2 + H2O
Une troisième méthode implique l’électrolyse du chlorure de magnésium en présence d’un sel de chlorate, tel que le chlorate de sodium ou de potassium. La réaction se déroule comme suit :
2MgCl2 + 2NaClO3 → Mg(ClO3)2 + 2NaCl
Dans cette méthode, le processus d’électrolyse utilise une anode de magnésium et utilise du sel de chlorate comme agent oxydant.
Utilisations du chlorate de magnésium
Le Mg(ClO3)2 a diverses utilisations dans différents domaines. Voici quelques-unes de ses applications :
- Produits pyrotechniques : Couramment utilisé comme oxydant dans les compositions pyrotechniques, telles que les fusées éclairantes, les feux d’artifice et les dispositifs de signalisation.
- Synthèse chimique : utilisé comme source d’oxygène dans la synthèse de divers produits chimiques, notamment des produits pharmaceutiques, des colorants et des explosifs.
- Agent de blanchiment : utilisé comme agent de blanchiment dans la production de papier, de pâte à papier et de textiles.
- Traitement de l’eau : Également utilisé comme agent de traitement de l’eau pour éliminer les impuretés et les bactéries présentes dans l’eau.
- Réactif de laboratoire : utilisé comme réactif de laboratoire dans diverses méthodes de chimie analytique.
- Agriculture : Utilisé comme engrais et amendement du sol pour fournir du magnésium et de l’oxygène aux plantes.
- Industrie pétrolière et gazière : Utilisé comme comburant dans les opérations de forage et de dynamitage dans l’industrie pétrolière et gazière.
Des questions:
Q : Quelle est la formule du chlorate de magnésium ?
R : Mg(ClO3)2.
Q : Combien d’atomes y a-t-il dans 2,1 moles de Mg(ClO3)2 ?
R : Il y a 5,04 x 10^24 atomes dans 2,1 moles de Mg(ClO3)2.
Q : Le chlorate de magnésium se décompose en quoi ?
R : Mg(ClO3)2 peut se transformer en chlorure de magnésium, en oxygène gazeux et en chlore gazeux lorsqu’il est chauffé.
Q : En quoi le chlorate de magnésium se décompose-t-il ?
R : Mg(ClO3)2 se décompose en chlorure de magnésium et en oxygène gazeux lorsqu’il est chauffé.
Q : Quel est le nombre total d’atomes d’oxygène présents dans une unité de Mg(ClO3)2 ?
R : Il y a 6 atomes d’oxygène présents dans une unité de Mg(ClO3)2.
Q : En quoi Mg(ClO3)2 se décompose-t-il ?
R : Mg(ClO3)2 se décompose pour former du MgCl2 et de l’O2 lorsqu’il est chauffé.
Q : Quel est le nombre total de moles d’atomes d’oxygène présentes dans une mole de Mg(ClO3)2 ?
R : Il y a 6 moles d’atomes d’oxygène présentes dans une mole de Mg(ClO3)2.
Q : Quelle est la masse en grammes de Mg(ClO3)2 ?
R : La masse de formule en grammes de Mg(ClO3)2 est de 232,21 g/mol.
Q : Le Mg(ClO3)2 est-il ionique ou moléculaire ?
R : Mg(ClO3)2 est un composé ionique.
