Le chlorate de calcium (Ca(ClO3)2) est un composé chimique composé de calcium, de chlore et d’oxygène. Il est couramment utilisé comme agent oxydant dans les feux d’artifice et les allumettes. Il peut également être utilisé pour stériliser du matériel dans l’industrie agroalimentaire.
| Nom UICPA | Chlorate de calcium |
| Formule moléculaire | Ca(ClO3)2 |
| Numero CAS | 10137-74-3 |
| Synonymes | Acide chlorique, sel de calcium ; Chlorate de calcium hydraté ; Perchlorate de calcium ; Calciochlorite; UN1456 |
| InChI | InChI=1S/Ca.2ClHO3/c;2 2-1(3)4/h;2 (H,2,3,4)/q+2;;/p-2 |
Propriétés du chlorate de calcium
Formule de chlorate de calcium
La formule du chlorate de calcium est Ca(ClO3)2. Il est composé d’un ion Ca2+ et de deux ions ClO3-. Le chlorate de calcium est un composé ionique, ce qui signifie qu’il est maintenu ensemble par attraction électrostatique entre les ions positifs et négatifs.
Chlorate De Calcium Masse molaire
La masse molaire de Ca(ClO3)2 est de 206,98 g/mol. Ceci peut être calculé en additionnant les masses atomiques de calcium, de chlore et d’oxygène qui composent le composé. La masse molaire est importante pour calculer la quantité de Ca(ClO3)2 nécessaire pour une réaction donnée.
Point d’ébullition du chlorate de calcium
Le Ca(ClO3)2 n’a pas de point d’ébullition car il se décompose avant d’atteindre son point d’ébullition. Lorsqu’il est chauffé, le Ca(ClO3)2 se décompose en chlorure de calcium (CaCl2) et en oxygène gazeux (O2). Cette décomposition est exothermique et peut être dangereuse si elle n’est pas manipulée correctement.
Chlorate de calcium Point de fusion
Le point de fusion du Ca(ClO3)2 est de 135°C. C’est la température à laquelle le composé solide passe de l’état solide à l’état liquide. Ca(ClO3)2 est un solide cristallin blanc à température et pression ambiantes.
Densité du chlorate de calcium g/mL
La densité de Ca(ClO3)2 est de 2,4 g/mL. Cela signifie qu’un millilitre de Ca(ClO3)2 pèse 2,4 grammes. La densité est une mesure de la densité des molécules dans une substance. Le Ca(ClO3)2 est plus dense que l’eau, qui a une densité de 1 g/mL.
Chlorate De Calcium Poids moléculaire
Le poids moléculaire de Ca(ClO3)2 est de 206,98 g/mol. C’est la même chose que la masse molaire et peut être calculée en additionnant les poids atomiques des éléments individuels du composé.
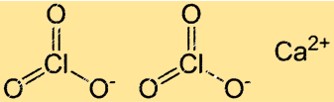
Structure du chlorate de calcium
Ca(ClO3)2 a une structure de réseau cristallin typique des composés ioniques. Dans cette structure, les ions Ca2+ et ClO3- sont disposés selon un motif régulier et répétitif. Chaque ion Ca2+ est entouré de six ions ClO3- et chaque ion chlorate est entouré de six ions calcium.
Solubilité du chlorate de calcium
Ca(ClO3)2 est soluble dans l’eau et forme une solution claire et incolore. La solubilité du Ca(ClO3)2 dans l’eau augmente avec la température. Cependant, il est moins soluble dans les solvants organiques tels que l’éthanol et l’acétone. Le Ca(ClO3)2 est également hygroscopique, ce qui signifie qu’il absorbe l’humidité de l’air. Cela peut rendre le composé humide ou se dissoudre avec le temps.
| Apparence | Solide cristallin blanc |
| Gravité spécifique | 2.4 |
| Couleur | Incolore |
| Odeur | Inodore |
| Masse molaire | 206,98 g/mole |
| Densité | 2,4 g/ml |
| Point de fusion | 135°C |
| Point d’ébullition | Se décompose avant le point d’ébullition |
| Point d’éclair | N’est pas applicable |
| Solubilité dans l’eau | Soluble |
| Solubilité | Soluble dans l’eau, moins soluble dans les solvants organiques |
| Pression de vapeur | N’est pas applicable |
| Densité de vapeur | N’est pas applicable |
| pKa | N’est pas applicable |
| pH | N’est pas applicable |
Sécurité et dangers du chlorate de calcium
Le Ca(ClO3)2 est considéré comme une substance dangereuse et doit être manipulé avec précaution. C’est un agent oxydant qui peut réagir violemment avec les matières organiques, provoquant des incendies et des explosions. L’inhalation ou l’ingestion de Ca(ClO3)2 peut provoquer une irritation respiratoire et gastro-intestinale. Une exposition prolongée peut entraîner une irritation cutanée, des brûlures et d’éventuelles réactions allergiques. Il est important de porter un équipement de protection individuelle approprié lors de la manipulation du Ca(ClO3)2, notamment des gants, des lunettes et un respirateur. En cas d’exposition, consulter immédiatement un médecin. Conservez le Ca(ClO3)2 dans un endroit frais, sec et bien ventilé, à l’écart des substances incompatibles.
| Symboles de danger | O, Xn |
| Description de la sécurité | Tenir à l’écart des matières organiques. Portez un équipement de protection individuelle. Conserver dans un endroit frais, sec et bien ventilé. |
| Numéros d’identification de l’ONU | UN1458 |
| Code SH | 2829.11.00 |
| Classe de danger | 5.1 |
| Groupe d’emballage | II |
| Toxicité | Toxique en cas d’ingestion ou d’inhalation. Peut provoquer une irritation de la peau et des yeux. Peut provoquer une irritation respiratoire. |
Méthodes de synthèse du chlorate de calcium
Pour synthétiser Ca(ClO3)2, on peut utiliser différentes méthodes.
Une méthode courante implique la réaction de l’hydroxyde de calcium avec du chlore gazeux. Dans ce processus, du chlorure de calcium est d’abord formé comme sous-produit, qui réagit avec le chlore restant pour former du Ca(ClO3)2.
Une autre méthode implique la réaction du carbonate de calcium avec de l’acide nitrique et du chlore gazeux. Pour obtenir du Ca(ClO3)2, on évapore et cristallise la solution obtenue.
Une autre approche implique l’électrolyse d’une solution contenant du chlorure de calcium et du chlorate de sodium. Ce processus donne du Ca(ClO3)2 et du chlorure de sodium comme produits finaux.
La réaction entre l’hypochlorite de calcium et le chlorate de sodium produit du Ca(ClO3)2, qui est ensuite purifié et cristallisé.
Utilisations du chlorate de calcium
Le Ca(ClO3)2 a plusieurs utilisations importantes dans diverses industries. Voici quelques-unes des applications les plus courantes du Ca(ClO3)2 :
- Agent de blanchiment : Utilisé comme agent de blanchiment dans l’industrie des pâtes et papiers.
- Feux d’artifice : agent oxydant couramment utilisé dans la production de feux d’artifice.
- Allumettes : Également utilisées dans la production d’allumettes de sécurité, car elles peuvent être facilement enflammées.
- Herbicides : Utilisé comme herbicide, car il peut tuer sélectivement certaines mauvaises herbes sans nuire aux cultures.
- Agent oxydant : utilisé comme agent oxydant dans la production d’autres produits chimiques, tels que les perchlorates et les chlorates.
- Produits pharmaceutiques : également utilisés dans la production de produits pharmaceutiques, tels que des médicaments anti-infectieux.
- Réactif de laboratoire : utilisé comme réactif de laboratoire pour la chimie analytique.
- Production de pigments : Utilisé dans la production de pigments, comme le bleu outremer.
Des questions:
Q : Quelle est la formule du chlorate de calcium ?
R : La formule chimique du chlorate de calcium est Ca(ClO3)2.
Q : À quoi sert le chlorate de calcium ?
R : Le Ca(ClO3)2 a diverses applications dans les industries, telles que l’agent de blanchiment dans l’industrie des pâtes et papiers, l’agent oxydant dans la production d’autres produits chimiques, l’herbicide, la production de pigments et les réactifs de laboratoire.
Q : Le chlorate de calcium est-il un solide ?
R : Oui, Ca(ClO3)2 est un solide à température ambiante.
Q : Où trouve-t-on le plus souvent le chlorate de sodium et à quoi sert le chlorate de calcium ?
R : Le chlorate de sodium se trouve le plus souvent dans l’industrie chimique, où il est utilisé comme agent oxydant et herbicide. Le Ca(ClO3)2, quant à lui, est utilisé comme agent de blanchiment, agent oxydant et herbicide dans diverses industries.
Q : Quel est le nombre total d’atomes dans le composé Ca(ClO3)2 ?
R : Le composé Ca(ClO3)2 a un total de 13 atomes : 1 atome de calcium, 2 atomes de chlore et 6 atomes d’oxygène provenant des deux ions ClO3-.
Q : Quel est le pourcentage massique de chlore dans Ca(ClO3)2 ?
R : La masse atomique du chlore est de 35,5 g/mol et la masse molaire du Ca(ClO3)2 est de 238,98 g/mol. Par conséquent, le pourcentage massique de chlore dans Ca(ClO3)2 est de (2 x 35,5 g/mol) / 238,98 g/mol x 100 % = 29,68 %.
Q : Combien d’atomes de chlore y a-t-il dans Ca(ClO3)2 ?
R : Il y a deux atomes de chlore dans Ca(ClO3)2, représentés par les deux groupes ClO3.
Q : Quelle est la masse de chaque composé dans le mélange original Ca(ClO3)2 et Ca(ClO)2 ?
R : Il est impossible de déterminer la masse de chaque composé dans le mélange original sans informations supplémentaires, comme la masse totale ou le rapport massique entre les deux composés.
