L’oxyde de calcium, également connu sous le nom de chaux vive, est une substance blanche et alcaline avec un point de fusion élevé. Il réagit vigoureusement avec l’eau pour produire de l’hydroxyde de calcium et génère une chaleur importante. Il est utilisé dans diverses applications industrielles, notamment la fabrication de ciment, l’agriculture et le traitement de l’eau.
| Nom UICPA | Oxyde de calcium |
| Formule moléculaire | CaO |
| Numero CAS | 1305-78-8 |
| Synonymes | Chaux vive; Chaux brûlée ; Citron vert; Calx; Chaux non éteinte ; Oxyde de calcium (II); Calcia; Galet de chaux ; Roche calcaire ; Monoxyde de calcium ; Fondant à la chaux |
| InChI | InChI=1S/Ca.O |
Propriétés de l’oxyde de calcium
Formule d’oxyde de calcium
La formule chimique de l’oxyde de calcium est CaO, ce qui indique qu’il contient un cation calcium (Ca2+) et un anion oxyde (O2-). La formule de l’oxyde de calcium reflète sa nature ionique, où les cations calcium et les anions oxyde sont maintenus ensemble par de fortes forces électrostatiques. La formule de l’oxyde de calcium est utilisée pour identifier le composé dans diverses réactions chimiques et pour calculer son poids moléculaire et d’autres propriétés physiques.
Oxyde De Calcium Masse molaire
La masse molaire de l’oxyde de calcium, également connue sous le nom de chaux vive, est de 56,077 grammes par mole. Il est dérivé du poids atomique du calcium (40,078 g/mol) et de l’oxygène (15,999 g/mol) qui composent le composé. La masse molaire de l’oxyde de calcium est utilisée dans divers calculs, tels que la détermination de la quantité de réactif nécessaire pour produire une quantité spécifique de produit ou le calcul de la concentration d’une solution.
Point d’ébullition de l’oxyde de calcium
L’oxyde de calcium n’a pas de point d’ébullition car il subit une décomposition thermique à haute température au lieu de bouillir. À des températures supérieures à 2 572 °C, l’oxyde de calcium se dissocie en calcium et en oxygène. Cependant, la décomposition thermique de l’oxyde de calcium peut être utilisée pour produire de l’oxyde de calcium avec une pureté et une réactivité plus élevées pour des applications industrielles.
Point de fusion de l’oxyde de calcium
Le point de fusion de l’oxyde de calcium est de 2 572 °C, ce qui en fait une substance à point de fusion élevé. Il a un point de fusion élevé en raison de sa nature ionique, où les cations calcium et les anions oxyde sont maintenus ensemble par de fortes forces électrostatiques. Le point de fusion élevé de l’oxyde de calcium le rend également utile dans les applications à haute température telles que la fabrication de l’acier et du ciment.
Densité d’oxyde de calcium g/ml
La densité de l’oxyde de calcium varie en fonction de sa structure cristalline et de sa pureté. La densité typique de l’oxyde de calcium est de 3,35 g/mL pour le matériau en vrac, tandis que la densité théorique est de 3,50 g/mL. La faible densité de l’oxyde de calcium est due à sa structure poreuse, qui lui permet d’absorber l’humidité de l’air et d’augmenter son poids et son volume.
Poids moléculaire de l’oxyde de calcium
Le poids moléculaire de l’oxyde de calcium, également appelé poids de formule ou masse molaire, est de 56,077 grammes par mole. Il est calculé en additionnant les poids atomiques du calcium et de l’oxygène qui composent le composé. Le poids moléculaire de l’oxyde de calcium est utilisé dans divers calculs, tels que la détermination de la quantité de réactif nécessaire pour produire une quantité spécifique de produit ou le calcul de la concentration d’une solution.
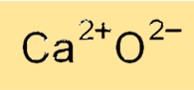
Structure de l’oxyde de calcium
L’oxyde de calcium a une structure cristalline cubique, où les cations calcium et les anions oxyde sont disposés dans un réseau cubique à faces centrées. La structure cristalline de l’oxyde de calcium est similaire à celle du chlorure de sodium et d’autres composés ioniques. La nature ionique de l’oxyde de calcium en fait un bon isolant électrique et un matériau important dans la fabrication de composants électroniques.
| Apparence | Solide blanc et inodore |
| Gravité spécifique | 3,35 g/cm³ |
| Couleur | Blanc |
| Odeur | Inodore |
| Masse molaire | 56,077 g/mole |
| Densité | 3,35 g/cm³ |
| Point de fusion | 2572 °C |
| Point d’ébullition | Ne bout pas, subit une décomposition thermique |
| Point d’éclair | N’est pas applicable |
| Solubilité dans l’eau | Réagit avec l’eau pour former de l’hydroxyde de calcium |
| Solubilité | Insoluble dans l’eau, soluble dans l’acide |
| Pression de vapeur | Négligeable |
| Densité de vapeur | N’est pas applicable |
| pKa | N’est pas applicable |
| pH | 12-13 |
Sécurité et dangers de l’oxyde de calcium
L’oxyde de calcium, également connu sous le nom de chaux vive, est une substance hautement réactive et caustique qui présente plusieurs dangers pour la santé humaine et l’environnement. Il peut provoquer de graves irritations et des brûlures de la peau, des yeux et du système respiratoire s’il n’est pas manipulé correctement. L’inhalation de poussières ou de vapeurs de chaux vive peut provoquer une détresse respiratoire, de la toux et un essoufflement. Il est également très réactif avec l’eau et peut libérer de grandes quantités de chaleur, entraînant des brûlures et des explosions par la vapeur. la chaux vive doit être stockée dans un endroit frais, sec et bien ventilé, à l’écart des substances incompatibles. Un équipement de protection et des procédures de manipulation appropriés doivent être suivis pour éviter les accidents et l’exposition.
| Symboles de danger | Corrosif (C) |
| Description de la sécurité | Portez des gants, des vêtements et une protection des yeux/du visage. Manipuler et conserver avec soin. Évitez l’inhalation, l’ingestion et le contact avec la peau et les yeux. |
| Numéros d’identification de l’ONU | ONU1910 |
| Code SH | 2522.20.00 |
| Classe de danger | 8 – Substances corrosives |
| Groupe d’emballage | II |
| Toxicité | Très toxique |
Méthodes de synthèse de l’oxyde de calcium
La décomposition thermique du calcaire, la réaction de l’hydroxyde de calcium avec la chaleur et l’électrolyse du chlorure de calcium synthétisent l’oxyde de calcium ou chaux vive.
La méthode la plus courante pour synthétiser la chaux vive consiste à chauffer la chaux à une température élevée d’environ 900 à 1 000 °C dans un four à chaux. Ce processus, connu sous le nom de calcination, libère du dioxyde de carbone et laisse de la chaux vive. Le traitement et le broyage de la chaux vive produisent une poudre fine pour de multiples applications.
Une autre méthode de synthèse de chaux vive consiste à chauffer l’hydroxyde de calcium, également connu sous le nom de chaux éteinte, à une température élevée. Ce processus, connu sous le nom de déshydroxylation, libère également de l’eau et laisse de la chaux vive.
L’électrolyse du chlorure de calcium est une méthode moins courante pour synthétiser la chaux vive. Dissoudre le chlorure de calcium dans l’eau et faire passer un courant électrique à travers la solution pour générer de la chaux vive et du chlore gazeux .
Utilisations de l’oxyde de calcium
L’oxyde de calcium, également connu sous le nom de chaux vive, a de nombreuses utilisations dans diverses industries en raison de ses propriétés uniques. Certaines de ses principales utilisations sont :
- Production d’acier : Utilisé comme fondant dans la production d’acier, où il aide à éliminer les impuretés et à améliorer la qualité de l’acier.
- Traitement de l’eau : Utilisé dans le traitement de l’eau pour éliminer les impuretés et ajuster le pH de l’eau.
- Agriculture : Utilisé en agriculture comme amendement du sol pour ajuster le pH du sol et fournir des nutriments essentiels aux plantes.
- Industrie chimique : utilisée dans la production de produits chimiques tels que le carbure de calcium, l’hypochlorite de calcium et le stéarate de calcium.
- Construction : Utilisé dans l’industrie de la construction comme composant du ciment, du mortier et du plâtre.
- Industrie alimentaire : Utilisé dans l’industrie alimentaire comme agent raffermissant et régulateur d’acidité.
- Industrie du papier : Utilisé dans l’industrie du papier comme composant de la liqueur blanche utilisée dans le processus de pâte kraft.
- Industrie pétrolière : Utilisé dans l’industrie pétrolière comme catalyseur dans le processus de raffinage.
Des questions:
Q : Quelle est la formule de l’oxyde de calcium ?
R : La formule de l’oxyde de calcium est CaO.
Q : Quel est l’indice d’oxydation du calcium ?
R : Le nombre d’oxydation du calcium dans l’oxyde de calcium est de +2.
Q : L’oxyde de calcium est-il ionique ou covalent ?
R : L’oxyde de calcium est un composé ionique composé d’ions calcium chargés positivement et d’ions oxyde chargés négativement.
Q : L’oxyde de calcium est-il un solide ?
R : Oui, l’oxyde de calcium est un solide à température ambiante et à pression standard. Il a un aspect blanc ou blanc grisâtre et est très réactif.
