Le méthanol (CH3OH) est un liquide incolore et inflammable avec une odeur sucrée. Il est utilisé comme solvant, carburant et antigel. Il peut être toxique s’il est ingéré et provoquer la cécité ou la mort.
| Nom UICPA | Méthanol |
| Formule moléculaire | CH4O |
| Numero CAS | 67-56-1 |
| Synonymes | Alcool méthylique, alcool de bois, hydroxyméthane, carbinol, naphta de bois, esprit colonial |
| InChI | InChI=1S/CH4O/c1-2/h2H,1H3 |
Remarque : InChI est une longue chaîne qui représente la structure unique d’une molécule. Il se peut que le rendu ne soit pas correct sur certains appareils.
Propriétés du méthanol
Méthanol Masse molaire
La masse molaire du méthanol est de 32,04 g/mol. Il est calculé en additionnant les poids atomiques des atomes de carbone, d’hydrogène et d’oxygène dans une seule molécule de méthanol. Cette valeur est utile pour déterminer la quantité de méthanol nécessaire pour préparer une certaine concentration d’une solution ou pour déterminer la stœchiométrie d’une réaction chimique.
Point d’ébullition du méthanol
Le méthanol a un point d’ébullition de 64,7 °C (148,46 °F). Ce point d’ébullition relativement bas rend le méthanol utile comme solvant dans diverses applications industrielles, notamment la production de formaldéhyde, d’acide acétique et de méthacrylate de méthyle. Cependant, le faible point d’ébullition du méthanol le rend également volatil et inflammable, ce qui peut présenter des risques pour la sécurité lors du stockage, de la manipulation et du transport.
Point de fusion du méthanol
CH3OH a un point de fusion de -97,6 °C (-143,68 °F). Cela signifie que CH3OH est un liquide à température ambiante mais peut être facilement congelé sous forme solide en le refroidissant en dessous de son point de fusion. Le faible point de fusion du CH3OH est également utile dans certaines applications de laboratoire, telles que la préparation de solvants cryogéniques pour la spectroscopie de résonance magnétique nucléaire.
Densité du méthanol g/mL
La densité du CH3OH est de 0,792 g/mL à 20 °C (68 °F). Cela signifie que CH3OH est moins dense que l’eau et peut flotter dessus. La densité de CH3OH peut également être utilisée pour calculer le volume de CH3OH nécessaire pour obtenir une certaine masse ou concentration de la solution.
Méthanol Poids moléculaire
Le poids moléculaire du CH3OH est de 32,04 g/mol. Cette valeur est calculée en additionnant les poids atomiques des atomes de carbone, d’hydrogène et d’oxygène dans une seule molécule de CH3OH. Le poids moléculaire du CH3OH est utile pour déterminer ses propriétés physiques, telles que le point d’ébullition, le point de fusion et la densité.
Structure du méthanol
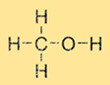
Le méthanol a une structure simple constituée d’un groupe méthyle (CH3) et d’un groupe hydroxyle (-OH) attachés à un seul atome de carbone. La formule moléculaire du méthanol est CH3OH. Le méthanol est une molécule polaire en raison de la présence du groupe hydroxyle, ce qui le rend soluble dans les solvants polaires tels que l’eau et l’éthanol.
Formule méthanol
La formule chimique du méthanol est CH3OH. Cela signifie que chaque molécule de méthanol contient un atome de carbone, quatre atomes d’hydrogène et un atome d’oxygène. La formule du méthanol peut être utilisée pour déterminer le poids moléculaire et d’autres propriétés physiques du méthanol. La formule chimique du méthanol est également utile pour écrire des équations chimiques et équilibrer les réactions chimiques impliquant le méthanol.
| Apparence | Liquide incolore |
| Gravité spécifique | 0,792 g/ml à 20°C |
| Couleur | Incolore |
| Odeur | Doux, piquant |
| Masse molaire | 32,04 g/mole |
| Densité | 0,792 g/ml à 20°C |
| Point de fusion | -97,6 °C |
| Point d’ébullition | 64,7°C |
| Point d’éclair | 11,1 °C |
| Solubilité dans l’eau | Miscible |
| Solubilité | Miscible avec l’éthanol, l’éther, l’acétone et de nombreux solvants organiques |
| La pression de vapeur | 13,02 kPa à 20°C |
| Densité de vapeur | 1,11 (air = 1) |
| pKa | 15,5 |
| pH | 7 (neutre) |
Remarque : Les valeurs répertoriées dans ce tableau sont approximatives et peuvent varier en fonction des conditions spécifiques et des sources de méthanol.
Sécurité et dangers du méthanol
CH3OH présente divers risques pour la sécurité et doit être manipulé avec prudence. C’est un liquide inflammable et peut s’enflammer s’il est exposé à la chaleur, à des étincelles ou à des flammes. Les vapeurs de CH3OH peuvent également former des mélanges explosifs avec l’air. L’inhalation de vapeurs de CH3OH peut provoquer des étourdissements, des maux de tête, des nausées et d’autres problèmes de santé. Le CH3OH est également toxique et peut être absorbé par la peau ou ingéré, entraînant de graves complications de santé, notamment la cécité, le coma et la mort. Il est important de porter des vêtements de protection et de manipuler le CH3OH dans un endroit bien ventilé avec un équipement de sécurité approprié, comme des lunettes, des gants et un respirateur. Les déversements doivent être nettoyés immédiatement et éliminés correctement.
| Symboles de danger | Crâne et os croisés, Inflammable |
| Description de la sécurité | Tenir à l’écart de la chaleur/des étincelles/des flammes nues/des surfaces chaudes. Utiliser un équipement électrique/de ventilation/d’éclairage antidéflagrant. Gardez le récipient bien fermé. Conteneur au sol/sous caution et équipement de réception. Utilisez uniquement des outils anti-étincelles. Prenez des mesures de précaution contre les décharges statiques. Évitez de respirer les vapeurs. Bien se laver après manipulation. Ne pas manger, boire ou fumer lorsque vous utilisez ce produit. |
| Identifiants ONU | UN1230 |
| Code SH | 29051100 |
| Classe de danger | 3 |
| Groupe d’emballage | II |
| Toxicité | Le méthanol est toxique et peut provoquer la cécité, le coma et la mort s’il est ingéré, inhalé ou absorbé par la peau. Il peut également provoquer des irritations, des rougeurs et des brûlures au contact. L’exposition aux vapeurs de méthanol peut provoquer des maux de tête, des étourdissements, des nausées et d’autres problèmes de santé. Le méthanol doit être manipulé avec une extrême prudence et avec un équipement de protection approprié. |
Remarque : Les valeurs répertoriées dans ce tableau sont approximatives et peuvent varier en fonction des conditions spécifiques et des sources de méthanol. Il est important de se référer à la fiche de données de sécurité et à la réglementation en vigueur lors de la manipulation du méthanol.
Méthodes de synthèse du méthanol
L’oxydation directe du méthane, l’oxydation partielle du gaz naturel, la gazéification du charbon et la synthèse à partir de dioxyde de carbone et d’hydrogène synthétisent toutes du méthanol.
L’une des méthodes les plus courantes de synthèse du méthanol consiste à convertir catalytiquement le gaz de synthèse, qui est un mélange de monoxyde de carbone, de dioxyde de carbone et d’hydrogène. Ce procédé implique l’utilisation d’un catalyseur, généralement à base de cuivre, pour faciliter la réaction. Le gaz de synthèse est introduit dans un réacteur contenant le catalyseur à des températures et des pressions élevées, entraînant la production de méthanol.
Une autre méthode de synthèse du méthanol consiste à oxyder directement le méthane, ce qui implique l’utilisation de températures et de pressions élevées en présence d’un catalyseur tel que le platine ou le palladium. Cette méthode est plus difficile et plus coûteuse que la méthode du gaz de synthèse, mais elle est plus efficace et peut produire des rendements plus élevés.
L’oxydation partielle du gaz naturel est une autre méthode de synthèse du méthanol, qui implique l’utilisation d’oxygène ou d’air pour oxyder partiellement le gaz naturel, produisant ainsi un mélange de monoxyde de carbone et d’hydrogène. Le mélange est ensuite introduit dans un réacteur contenant un catalyseur, entraînant la production de méthanol.
La gazéification du charbon est une autre méthode de synthèse du méthanol, qui implique la conversion du charbon en gaz de synthèse, suivie du même processus de conversion catalytique que celui décrit ci-dessus.
Le captage et l’utilisation du carbone convertissent les émissions de dioxyde de carbone provenant des processus industriels en méthanol, en utilisant l’hydrogène comme agent réducteur.
Utilisations du méthanol
Le méthanol a un large éventail d’utilisations dans diverses industries, notamment :
- Carburant : les véhicules, les générateurs et autres équipements industriels peuvent utiliser du méthanol comme carburant.
- Solvant : Le méthanol est un excellent solvant pour de nombreuses substances, notamment les résines, les colorants et les huiles. Les fabricants utilisent du méthanol pour produire des peintures, des vernis et d’autres revêtements.
- Intermédiaire chimique : utilisé comme matière première pour la production de formaldéhyde, d’acide acétique et d’autres produits chimiques.
- Antigel : Utilisé comme agent antigel dans les systèmes de refroidissement des automobiles.
- Agent de dégivrage : Utilisé comme agent de dégivrage pour les ailes d’avion et les pistes d’aéroport.
- Nettoyant : Utilisé comme agent de nettoyage dans divers processus industriels.
- Produits pharmaceutiques : Utilisés comme solvant dans la production de nombreux produits pharmaceutiques.
- Énergie alternative : étudiée comme combustible alternatif pour les piles à combustible et comme support potentiel de stockage d’énergie.
- Méthanol en oléfines (MTO) : les oléfines telles que l’éthylène et le propylène proviennent de la conversion du méthanol.
- Méthanol en essence (MTG) : Un processus appelé MTG convertit le méthanol en essence.
Des questions:
Q : Qu’est-ce que le méthanol ?
R : Le méthanol, également connu sous le nom d’alcool de bois, est un liquide incolore et inflammable avec une odeur sucrée. C’est l’alcool le plus simple et sa formule chimique est CH3OH.
Q : Le méthanol est-il polaire ou non polaire ?
R : Le méthanol est une molécule polaire. Il a une charge partielle positive sur les atomes d’hydrogène et une charge partielle négative sur l’atome d’oxygène, ce qui entraîne un moment dipolaire.
Q : À quoi sert le méthanol ?
R : Le méthanol a un large éventail d’utilisations dans diverses industries, notamment comme carburant, solvant, intermédiaire chimique, antigel, agent de dégivrage, nettoyant, solvant pharmaceutique et support de stockage d’énergie potentiel. Il est également utilisé dans la production de formaldéhyde, d’acide acétique et d’autres produits chimiques. De plus, le méthanol est converti en oléfines telles que l’éthylène et le propylène, qui sont utilisées comme matières premières pour la production de plastiques.
