Le fluorométhane (CH3F) est un gaz incolore avec une légère odeur éthérée. Il est utilisé dans la production de produits électroniques, pharmaceutiques et comme réfrigérant. Il est peu toxique mais constitue un puissant gaz à effet de serre.
| Nom UICPA | Fluorométhane |
| Formule moléculaire | CH3F |
| Numero CAS | 593-53-3 |
| Synonymes | Fluorure de méthyle, Fréon 41, Halocarbure 41, R 41, UN 2452 |
| InChI | InChI=1S/CH3F/c1-2/h1H3 |
Propriétés du fluorométhane
CH3F Point d’ébullition
Le point d’ébullition du CH3F est de -78,4°C, ce qui est relativement bas. Cela en fait un réfrigérant idéal pour diverses applications telles que les systèmes de réfrigération et de climatisation. Le CH3F est également utilisé comme propulseur dans les aérosols en raison de son faible point d’ébullition.
CH3F Masse molaire
CH3F est un composé chimique de formule moléculaire CH3F. Il est également connu sous le nom de fluorure de méthyle et possède une masse molaire de 34,03 g/mol. Le CH3F est un gaz incolore avec une légère odeur éthérée et est largement utilisé dans diverses applications en raison de ses propriétés uniques.
CH3F Point de fusion
Le CH3F a un point de fusion de -141°C, ce qui est également relativement bas. Son faible point de fusion le rend facile à manipuler et à transporter, ce qui en fait un choix populaire pour diverses applications industrielles. Le faible point de fusion du CH3F le rend également adapté à une utilisation comme réfrigérant dans les applications à basse température.
Densité CH3F
La densité du CH3F est de 0,89 g/ml, ce qui est relativement faible. Cela le rend moins dense que l’air, qui a une densité de 1,29 g/ml. En conséquence, le CH3F est souvent utilisé comme gaz plus léger que l’air dans diverses applications, notamment la détection de fuites, la chromatographie en phase gazeuse et comme gaz de levage pour les ballons et les dirigeables.
CH3F Poids moléculaire
Le poids moléculaire du CH3F est de 34,03 g/mol, ce qui est relativement faible. Cela en fait un composé léger, facile à manipuler et à transporter. Le CH3F est souvent utilisé dans la production de produits électroniques et pharmaceutiques en raison de son faible poids moléculaire et de ses propriétés uniques.
Structure du CH3F
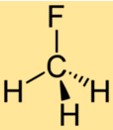
La structure du CH3F est constituée d’un seul atome de carbone lié à trois atomes d’hydrogène et un atome de fluor. L’atome de fluor est attaché à l’atome de carbone, remplaçant l’un des atomes d’hydrogène du méthane. La structure du CH3F en fait un composé stable doté de propriétés chimiques uniques.
Formule Fluorométhane
La formule du fluorométhane est CH3F, qui représente la disposition des atomes dans la molécule. La formule montre que le fluorométhane est constitué d’un atome de carbone, de trois atomes d’hydrogène et d’un atome de fluor. La formule est utilisée pour décrire la composition chimique du fluorométhane et est importante dans diverses applications.
| Apparence | Gaz incolore |
| Gravité spécifique | 0,89 à 20°C (air = 1) |
| Couleur | Incolore |
| Odeur | Légère odeur éthérée |
| Masse molaire | 34,03 g/mole |
| Densité | 0,89 g/ml |
| Point de fusion | -141°C |
| Point d’ébullition | -78,4°C |
| Point d’éclair | Ininflammable |
| Solubilité dans l’eau | 0,5 g/L à 20°C |
| Solubilité | Miscible dans les solvants organiques |
| Pression de vapeur | 4,4 bars à 20°C |
| Densité de vapeur | 1,43 (air = 1) |
| pKa | 50,9 |
| pH | N’est pas applicable |
Sécurité et dangers du fluorométhane
Le fluorométhane est généralement considéré comme un composé sûr à manipuler et à utiliser, peu toxique et ininflammable. Cependant, comme tout produit chimique, il présente des dangers potentiels et des considérations de sécurité. L’exposition à des concentrations élevées de fluorométhane peut provoquer des étourdissements, des maux de tête et des nausées. C’est également un puissant gaz à effet de serre qui contribue au changement climatique. Le fluorométhane doit être manipulé dans un endroit bien ventilé et des équipements de protection, tels que des gants et des lunettes, doivent être portés. Il est important de suivre des procédures appropriées de stockage et de manipulation pour éviter les fuites et les rejets accidentels dans l’environnement.
| Symboles de danger | F+ |
| Description de la sécurité | Gaz hautement inflammable ; Toxique par inhalation ; Provoque une irritation cutanée ; Provoque une grave irritation des yeux ; Peut provoquer somnolence ou étourdissements ; Peut causer des dommages aux organes |
| Identifiants ONU | UN2452 |
| Code SH | 2903.49.90 |
| Classe de danger | 2.1 |
| Groupe d’emballage | II |
| Toxicité | Faible toxicité, mais peut avoir des effets sur la santé en cas d’inhalation à fortes concentrations. |
Méthodes de synthèse du fluorométhane
Plusieurs méthodes, notamment la fluoration directe du méthane et les réactions d’échange d’halogène, peuvent synthétiser du fluorométhane.
Une méthode courante est la réaction du méthanol avec le fluorure d’hydrogène en présence d’un catalyseur, tel que l’oxyde d’aluminium ou le fluorure d’aluminium.
Une autre méthode implique la réaction du chlorométhane ou du bromométhane avec du fluorure d’hydrogène gazeux. Ces deux méthodes produisent du fluorométhane comme sous-produit, qui peut ensuite être séparé et purifié par distillation ou par d’autres méthodes.
Une autre méthode de synthèse du fluorométhane implique la réaction du fluoroforme et du chlorure d’hydrogène en présence d’un catalyseur, tel que le zinc ou le cuivre. Cette réaction produit un mélange de chlorofluorométhane et de fluorométhane, qui peut être séparé et purifié par distillation.
Utilisations du fluorométhane
Le fluorométhane a plusieurs utilisations dans diverses industries, notamment :
- Réfrigération : Utilisé comme réfrigérant dans les systèmes de réfrigération industriels et commerciaux en raison de son faible point d’ébullition et de son ininflammabilité.
- Électronique : utilisé comme agent de nettoyage pour les composants électroniques et comme agent de gravure au plasma dans l’industrie des semi-conducteurs.
- Applications médicales : Utilisé comme anesthésique en médecine vétérinaire en raison de sa faible toxicité et de son action rapide.
- Production de pesticides : Utilisé comme précurseur dans la production de certains pesticides, notamment les herbicides et les insecticides.
- Production de polymères : utilisé comme agent gonflant dans la production de mousses polymères, telles que la mousse de polyuréthane.
- Applications en laboratoire : utilisé comme solvant et réactif dans diverses applications de laboratoire, notamment la synthèse et l’analyse chimiques.
- Suppression des incendies : Également utilisé comme agent d’extinction d’incendie dans certains types d’extincteurs, en particulier ceux utilisés dans les salles informatiques et de télécommunications.
Des questions:
Q : CH3F est-il polaire ou non polaire ?
R : CH3F est une molécule polaire en raison de la disposition asymétrique des atomes de fluor et d’hydrogène autour de l’atome de carbone central, ce qui entraîne un moment dipolaire net.
Q : Le CH3F a-t-il une liaison hydrogène ?
R : Le fluorométhane n’a pas de liaison hydrogène car il ne contient pas d’atome d’hydrogène lié à un élément hautement électronégatif tel que l’azote, l’oxygène ou le fluor.
Q : Quel composé possède les forces intermoléculaires les plus fortes : HF, CH3Cl, CH3F, HCl ?
R : Le HF possède les forces intermoléculaires les plus fortes en raison de sa capacité à former des liaisons hydrogène, qui sont plus fortes que les forces dipolaires-dipôles des autres composés.
Q : Lequel a les forces dipolaires-dipôles les plus faibles : N2, CO, CH3F, HCl ?
R : N2 a les forces dipolaires-dipôles les plus faibles car c’est une molécule non polaire et n’a donc pas de moment dipolaire net. CO, CH3F et HCl sont des molécules polaires et ont des forces dipolaires-dipôles, mais la force de ces forces augmente dans l’ordre HCl < CH3F < CO en raison de la polarité croissante des molécules.
