Le tétrabromométhane est un composé chimique de formule CBr4. C’est un solide cristallin incolore à odeur sucrée, utilisé comme solvant et ignifuge. Il est toxique et peut nuire aux humains et à l’environnement.
| Nom UICPA | Tétrabromométhane |
| Formule moléculaire | CBr4 |
| Numero CAS | 558-13-4 |
| Synonymes | Tétrabromure de carbone, tétrabromoforme, perbromométhane, tétra-bromo-méthane |
| InChI | InChI=1S/CBr4/c2-1(3,4)5 |
Propriétés du tétrabromométhane
Masse molaire CBr4
Le tétrabromométhane a une masse molaire d’environ 331,63 g/mol. C’est un composé relativement lourd par rapport aux autres molécules organiques. La masse molaire du tétrabromométhane est déterminée en additionnant les masses atomiques de tous les atomes de la molécule. Dans ce cas, il est constitué d’un atome de carbone et de quatre atomes de brome.
Point d’ébullition du CBr4
Le tétrabromométhane a un point d’ébullition de 189 °C (372 °F). Il s’agit de la température à laquelle la pression de vapeur du tétrabromométhane liquide est égale à la pression atmosphérique. À cette température, le tétrabromométhane liquide commencera à bouillir et à s’évaporer en gaz.
Point de fusion du CBr4
CBr4 a un point de fusion de 90,5 °C (194,9 °F). C’est la température à laquelle le CBr4 solide passe à l’état liquide. Le CBr4 a un point de fusion relativement élevé pour une molécule organique, probablement en raison de son poids moléculaire élevé et de ses forces intermoléculaires.
Densité CBr4 g/ml
La densité du tétrabromométhane est de 3,42 g/mL à température ambiante. Cela signifie qu’un certain volume de tétrabromométhane pèse 3,42 fois plus que le même volume d’eau. La densité élevée du tétrabromométhane est due à son poids moléculaire élevé et à la disposition serrée de ses atomes.
Poids moléculaire CBr4
Le poids moléculaire du tétrabromométhane est de 331,63 g/mol. C’est le poids combiné de tous les atomes de la molécule. Le poids moléculaire du tétrabromométhane est important pour calculer ses propriétés physiques et pour comprendre son comportement dans les réactions chimiques.
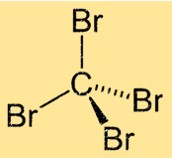
Structure CBr4
Le tétrabromométhane a une géométrie moléculaire tétraédrique, avec l’atome de carbone au centre et les quatre atomes de brome qui y sont liés. La molécule a une structure symétrique avec quatre liaisons Br-C identiques disposées à angles égaux autour de l’atome de carbone central. Cette structure confère au tétrabromométhane ses propriétés physiques et chimiques uniques.
Formule tétrabromométhane
La formule du tétrabromométhane est CBr4. Cela signifie qu’il est constitué d’un atome de carbone et de quatre atomes de brome. La formule du tétrabromométhane est importante pour comprendre sa structure chimique et prédire sa réactivité avec d’autres molécules.
| Apparence | Solide cristallin incolore à jaune pâle |
| Gravité spécifique | 3,42 g/ml |
| Couleur | Incolore à jaune pâle |
| Odeur | Doux |
| Masse molaire | 331,63 g/mole |
| Densité | 3,42 g/ml |
| Point de fusion | 90,5 °C (194,9 °F) |
| Point d’ébullition | 189 °C (372 °F) |
| Point d’éclair | Ininflammable |
| Solubilité dans l’eau | 0,0032 g/100 mL à 20°C |
| Solubilité | Insoluble dans l’eau, soluble dans le benzène, le chloroforme et le sulfure de carbone |
| Pression de vapeur | 0,006 mmHg à 25°C |
| Densité de vapeur | 14.2 (contre l’air) |
| pKa | N’est pas applicable |
| pH | N’est pas applicable |
Sécurité et dangers du tétrabromométhane
Le tétrabromométhane peut présenter plusieurs dangers s’il n’est pas manipulé correctement. Il est nocif s’il est ingéré, inhalé ou s’il entre en contact avec la peau. L’exposition au tétrabromométhane peut provoquer des irritations, des maux de tête, des étourdissements et des nausées. Une exposition prolongée peut entraîner des lésions hépatiques et rénales. Il s’agit également d’un danger potentiel pour l’environnement et ne doit pas être rejeté dans l’environnement. Des précautions appropriées, y compris l’utilisation de vêtements et d’équipements de protection, doivent être prises lors de la manipulation du tétrabromométhane. En cas d’exposition accidentelle, des soins médicaux immédiats doivent être recherchés. Le tétrabromométhane doit être stocké et manipulé dans un endroit bien ventilé et conformément aux protocoles de sécurité appropriés.
| Symboles de danger | T (toxique) |
| Description de la sécurité | Ne pas ingérer, inhaler ou entrer en contact avec la peau. Portez des vêtements et des équipements de protection. En cas d’exposition accidentelle, consulter un médecin. |
| Numéros d’identification de l’ONU | ONU 2515 |
| Code SH | 2903.90.9000 |
| Classe de danger | 6.1 |
| Groupe d’emballage | II |
| Toxicité | Toxique en cas d’ingestion, d’inhalation ou d’absorption par la peau. Peut provoquer une irritation, des maux de tête, des étourdissements et des nausées. Une exposition prolongée peut provoquer des lésions hépatiques et rénales. |
Méthodes de synthèse du tétrabromométhane
Pour synthétiser le tétrabromométhane, les chercheurs peuvent bromer le méthane , faire réagir le tétrabromure de carbone avec de l’hydrogène gazeux ou faire réagir le brome avec le formiate de sodium.
La bromation du méthane implique la réaction du méthane avec le brome en présence d’un catalyseur, tel que le bromure de fer ou d’aluminium. Vous pouvez séparer et purifier le mélange de bromométhanes résultant du procédé pour obtenir le Tétrabromométhane.
Pour synthétiser le tétrabromométhane, on peut faire réagir le tétrabromure de carbone avec de l’hydrogène gazeux en présence d’un catalyseur tel que le nickel. Cette réaction produit un mélange de bromométhanes, que les chercheurs peuvent séparer et purifier pour obtenir du tétrabromométhane.
Une autre méthode de synthèse du tétrabromométhane implique la réaction du brome avec le formiate de sodium en présence d’acide sulfurique. La séparation et la purification du produit résultant de tétrabromométhane et de sulfate de sodium donneront du tétrabromométhane.
Utilisations du tétrabromométhane
Le tétrabromométhane a plusieurs applications dans diverses industries en raison de ses propriétés uniques. Voici quelques-unes de ses utilisations :
- Ignifuge : utilisé comme ignifuge dans les plastiques, les textiles et d’autres matériaux. Il agit en libérant du brome lorsqu’il est exposé à la chaleur, ce qui inhibe le processus de combustion.
- Intermédiaire chimique : utilisé comme intermédiaire chimique dans la production d’autres produits chimiques, tels que les produits pharmaceutiques et agrochimiques.
- Solvant : Utilisé comme solvant pour divers composés organiques, notamment dans la production de pesticides.
- Agent de test : utilisé comme agent de test pour la détection d’impuretés dans d’autres produits chimiques.
- Agent de raffinage : utilisé comme agent de raffinage dans la production d’aluminium et d’autres métaux.
- Médecine vétérinaire : Utilisé en médecine vétérinaire comme anthelminthique ou vermifuge pour le traitement des infections parasitaires chez les animaux.
Des questions:
Q : Le CBR4 est-il polaire ou non polaire ?
R : Le tétrabromométhane (cbr4) est une molécule non polaire en raison de sa structure tétraédrique symétrique et de l’absence de liaisons polaires.
Q : Lesquels des composés suivants sont polaires : cbr4, xef2, scl4, brf3, ch3oh ?
R : Parmi les composés donnés, seuls CH3OH (méthanol) et BRF3 (trifluorure de brome) sont des molécules polaires en raison de leurs structures moléculaires asymétriques et de la présence de liaisons polaires.
Q : Le cbr4 est-il soluble dans l’eau ?
R : Le tétrabromométhane n’est pas soluble dans l’eau en raison de sa nature non polaire, incompatible avec la nature polaire de l’eau.
Q : Quel est le nom du composé de formule cbr4 ? R : Le composé de formule cbr4 est appelé tétrabromométhane ou tétrabromure de carbone.
