Le carbonate de zinc (ZnCO3) est un solide blanc et inodore formé par la réaction du zinc avec les ions carbonate. Il est utilisé dans diverses applications, comme la céramique et les produits pharmaceutiques, en raison de ses propriétés uniques.
| Nom UICPA | Carbonate de zinc |
| Formule moléculaire | ZnCO3 |
| Numero CAS | 3486-35-9 |
| Synonymes | Carbonate de Zinc(II); Smithsonite ; Zinc carbonaté; Carbonate de zinc |
| InChI | InChI=1S/CH2O3.Zn/c2-1(3)4;/h(H2,2,3,4);/q;+2/p-2 |
Propriétés du carbonate de zinc
Formule de carbonate de zinc
La formule chimique du carbonate de zinc est ZnCO3. Il se compose d’un atome de zinc (Zn), d’un atome de carbone (C) et de trois atomes d’oxygène (O). Ce composé est un solide blanc et inodore et se trouve couramment dans la nature sous le nom de smithsonite minérale.
Carbonate De Zinc Masse molaire
La masse molaire du carbonate de zinc peut être calculée en additionnant les masses atomiques de ses éléments constitutifs. Le zinc a une masse molaire d’environ 65,38 g/mol, le carbone 12,01 g/mol et l’oxygène 16,00 g/mol (environ). Ainsi, la masse molaire du carbonate de zinc est d’environ 125,38 g/mol.
Point d’ébullition du carbonate de zinc
Le carbonate de zinc n’a pas de point d’ébullition distinct car il se décompose lorsqu’il est chauffé, libérant du dioxyde de carbone et laissant derrière lui de l’oxyde de zinc (ZnO). Il est cependant stable jusqu’à des températures avoisinant les 300°C.
Carbonate de Zinc Point de fusion
Le point de fusion du carbonate de zinc est d’environ 333°C (environ). À cette température, le carbonate de zinc subit une décomposition thermique et forme de l’oxyde de zinc et du dioxyde de carbone.
Densité du Carbonate de Zinc g/mL
La densité du carbonate de zinc est d’environ 4,398 g/mL (environ). Cette valeur indique que le carbonate de zinc est un solide relativement dense par rapport à de nombreux autres composés.
Carbonate De Zinc Poids moléculaire
Le poids moléculaire du carbonate de zinc, également appelé masse molaire, est d’environ 125,38 g/mol. C’est la masse d’une mole de molécules de carbonate de zinc et est utilisée dans divers calculs chimiques.
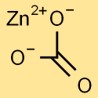
Structure du carbonate de zinc
Le carbonate de zinc a une structure cristalline trigonale. Le cation zinc (Zn2+) est entouré d’anions carbonate (CO32-) dans un arrangement plan trigonal. Cet arrangement confère au carbonate de zinc ses propriétés physiques et chimiques uniques.
Solubilité du carbonate de zinc
Le carbonate de zinc est peu soluble dans l’eau. Sa solubilité diminue avec la diminution de la température et l’augmentation du pH. Il peut également se dissoudre dans des solutions acides en raison de la formation de sels de zinc solubles. Cependant, il forme des précipités insolubles en présence de carbonates ou d’hydroxydes.
| Apparence | Solide blanc |
| Gravité spécifique | 4,398 g/ml (environ) |
| Couleur | Blanc |
| Odeur | Inodore |
| Masse molaire | 125,38 g/mole |
| Densité | 4,398 g/ml (environ) |
| Point de fusion | 333°C (environ) |
| Point d’ébullition | Se décompose |
| Point d’éclair | N’est pas applicable |
| Solubilité dans l’eau | Peu soluble |
| Solubilité | Insoluble dans la plupart des solvants, peut également se dissoudre dans les solutions acides |
| La pression de vapeur | Pas disponible |
| Densité de vapeur | Pas disponible |
| pKa | Pas disponible |
| pH | Légèrement alcalin (environ 8-9) |
Sécurité et dangers du carbonate de zinc
Le carbonate de zinc présente certains risques pour la sécurité qui nécessitent une attention particulière. Il peut irriter la peau, les yeux et le système respiratoire par contact ou par inhalation. Évitez l’ingestion car cela peut provoquer des troubles gastro-intestinaux. Lors de la manipulation, portez un équipement de protection individuelle approprié, comme des gants et des lunettes, pour éviter tout contact direct. Conservez le carbonate de zinc dans un endroit frais et sec, à l’écart des substances incompatibles. En cas d’ingestion ou d’exposition accidentelle, consulter immédiatement un médecin. De plus, suivez les procédures appropriées d’élimination des déchets pour ce composé afin de minimiser l’impact sur l’environnement. Des pratiques de manipulation et de stockage appropriées sont essentielles pour garantir une utilisation sûre du carbonate de zinc dans diverses applications.
| Symboles de danger | Aucun |
| Description de la sécurité | Nocif en cas d’ingestion ou d’inhalation. Irritant pour la peau et les yeux. Évitez les contacts. Utiliser avec une ventilation adéquate. |
| Numéros d’identification de l’ONU | N’est pas applicable |
| Code SH | 28369900 |
| Classe de danger | Non classés |
| Groupe d’emballage | N’est pas applicable |
| Toxicité | Toxicité faible à modérée |
Méthodes de synthèse du carbonate de zinc
Le carbonate de zinc peut être synthétisé par diverses méthodes. Une approche courante consiste à faire réagir l’oxyde de zinc (ZnO) avec du dioxyde de carbone (CO2) en présence d’eau ou d’un solvant approprié. La réaction peut être effectuée à une température et une pression contrôlées pour favoriser la formation de carbonate de zinc.
Une autre méthode implique la réaction du chlorure de zinc (ZnCl2) ou du sulfate de zinc (ZnSO4) avec du carbonate de sodium (Na2CO3) ou du carbonate de potassium (K2CO3) dans une solution aqueuse. Ce processus forme du carbonate de zinc sous forme de précipité, qui peut être séparé et collecté.
De plus, le carbonate de zinc peut être obtenu par carbonatation d’hydroxyde de zinc (Zn(OH)2) ou d’oxyde de zinc avec du dioxyde de carbone, soit sous forme gazeuse, soit dissous dans l’eau.
En milieu industriel, le carbonate de zinc est souvent produit comme sous-produit du traitement du zinc ou à la suite de réactions impliquant des matériaux contenant du zinc.
Il est essentiel de garantir les bonnes conditions de stœchiométrie et de réaction lors de la synthèse pour obtenir un produit pur et de haute qualité. Le choix de la méthode dépend de facteurs tels que la disponibilité des réactifs, la pureté souhaitée du produit et l’application prévue du carbonate de zinc.
Utilisations du carbonate de zinc
Le carbonate de zinc trouve diverses applications dans diverses industries en raison de ses propriétés uniques. Voici quelques utilisations notables :
- Céramiques : le carbonate de zinc abaisse activement le point de fusion des matériaux et améliore leur brillance et leur transparence lorsqu’il est utilisé comme agent fondant dans les émaux céramiques.
- Produits pharmaceutiques : Dans les applications médicinales, le carbonate de zinc sert d’ingrédient actif dans certaines formulations antiseptiques et astringentes.
- Peintures : Le carbonate de zinc fonctionne activement comme un pigment blanc dans les peintures et les revêtements, offrant une brillance et un excellent pouvoir couvrant.
- Industrie du caoutchouc : Dans le processus de vulcanisation, le carbonate de zinc agit comme un accélérateur, améliorant activement les propriétés mécaniques des produits en caoutchouc.
- Industrie textile : En tant que mordant, le carbonate de zinc améliore activement la rétention des colorants sur les tissus pendant le processus de teinture.
- Electronique : le carbonate de zinc trouve une application active dans les composants électroniques et comme matériau de revêtement pour semi-conducteurs, grâce à ses propriétés électriques.
- Agriculture : Le carbonate de zinc fonctionne activement comme un fongicide et un agent préventif contre la moisissure pour les cultures.
- Fabrication du verre : Dans le processus de fabrication du verre, le carbonate de zinc agit comme un agent fondant, abaissant activement le point de fusion du verre et améliorant sa clarté.
- Additif pour l’alimentation animale : les fabricants ajoutent activement du carbonate de zinc aux aliments pour animaux en tant que source cruciale de zinc essentiel, qui soutient activement la santé globale du bétail.
- Traitement de l’eau : les installations de traitement de l’eau utilisent activement le carbonate de zinc dans leurs processus pour contrôler activement les niveaux de pH et éliminer activement les impuretés de métaux lourds.
La polyvalence du carbonate de zinc dans diverses industries met en évidence son importance en tant que composé précieux avec un large éventail d’applications pratiques.
Des questions:
Q : Le ZnCO3 est-il soluble dans l’eau ?
R : Le carbonate de zinc est peu soluble dans l’eau.
Q : Quelle réaction aura le plus de chances de se produire ? Pt + FeCl3 Mn + CaO Li + ZnCO3 Cu + 2KNO3
R : La réaction la plus probable est Li + ZnCO3.
Q : Quelle masse de ZnCO3 contient 3,11×10^22 atomes d’O ?
R : La masse de ZnCO3 contenant 3,11×10^22 atomes d’O peut être calculée en fonction de la masse molaire et de la stœchiométrie du composé.
Q : Quel est le nom du ZnCO3 ?
R : Le nom du ZnCO3 est Carbonate de Zinc.
Q : Lequel des composés suivants est soluble dans l’eau ? Cu3(PO4)2, CoS, Pb(NO3)2, ZnCO3 ?
R : Le ZnCO3 est peu soluble dans l’eau.
Q : Quel type de liaison se forme entre ZnCO3 ?
R : Des liaisons ioniques se forment entre ZnCO3.
Q : Le carbonate de zinc est-il soluble dans l’eau ?
R : Le carbonate de zinc est peu soluble dans l’eau.
Q : Qu’est-ce qu’une batterie carbone-zinc ?
R : Une batterie carbone-zinc est un type de batterie sèche qui utilise une anode de zinc et une cathode de carbone avec une pâte électrolytique.
Q : En quoi une pile alcaline diffère-t-elle d’une pile sèche zinc-carbone ?
R : Les piles alcalines ont une densité énergétique plus élevée et une durée de vie plus longue que les piles sèches zinc-carbone en raison de l’utilisation d’un électrolyte alcalin.
Q : Quelle est la différence entre les piles carbone-zinc et alcalines ?
R : Les piles carbone-zinc ont une capacité énergétique inférieure et une durée de vie plus courte que les piles alcalines en raison des différences d’électrolyte et de construction.
Q : Pouvez-vous utiliser des piles carbone-zinc au lieu des piles alcalines ?
R : Oui, mais les piles carbone-zinc peuvent avoir une durée de vie plus courte et sont moins adaptées aux appareils à forte consommation que les piles alcalines.
