Le carbonate de sodium ou carbonate de sodium est un composé inorganique de formule chimique Na2CO3. C’est un sel alcalin, de couleur blanche et soluble dans l’eau. Il est utilisé dans de nombreux processus industriels et commerciaux, comme dans la fabrication du verre, du papier, des savons, des détergents et des produits de nettoyage.
| Nom UICPA | Le carbonate de sodium |
| Formule moléculaire | Na2CO3 |
| Numero CAS | 497-19-8 |
| Synonymes | Na2CO3 anhydre, Na2CO3 décahydraté, soude de lavage, carbonate de sodium |
| InChI | InChI=1S/2Na.CO3/c21-3(2)4;/h2(H,1,2,3,4);/q;;+2/p-2 |
Propriétés du carbonate de sodium
Carbonate De Sodium Masse molaire
La masse molaire du carbonate de sodium est de 106,0 g/mol. C’est la somme des masses atomiques de tous les atomes d’une molécule de carbonate de sodium. La masse molaire est une propriété physique importante utilisée dans de nombreux calculs en chimie et dans d’autres sciences.
Point d’ébullition du carbonate de sodium
Le carbonate de sodium a un point d’ébullition de 1 600°C. Il s’agit de la température à laquelle la pression de vapeur du liquide est égale à la pression de l’atmosphère environnante et le liquide bout. Le point d’ébullition est une propriété utile pour identifier et séparer différents composés.
Carbonate De Sodium Point De Fusion
Na2CO3 a un point de fusion de 851°C. C’est la température à laquelle la forme solide du composé se transforme en liquide. Le point de fusion est une propriété importante utilisée dans l’identification et la purification de différentes substances.
Densité du Carbonate de Sodium g/mL
Na2CO3 a une densité de 2,54 g/mL. La densité est définie comme la masse par unité de volume d’une substance et constitue une propriété utile pour déterminer la concentration d’une solution.
Carbonate De Sodium Poids moléculaire
Le poids moléculaire du carbonate de sodium est de 106 g/mol. C’est la somme des poids atomiques de tous les atomes d’une molécule. Le poids moléculaire est une propriété importante utilisée dans de nombreux calculs en chimie et dans d’autres sciences.
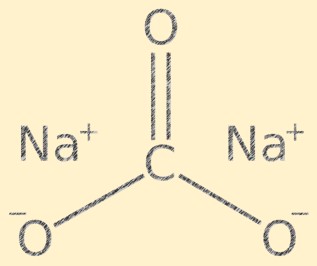
Structure du carbonate de sodium
Na2CO3 a une structure cristalline et est composé de cations sodium (Na+) et d’anions carbonate (CO3-). L’ion carbonate a une forme plane trigonale, avec l’atome de carbone au centre et les atomes d’oxygène qui y sont liés selon un angle de 120 degrés. Les ions sodium et les ions carbonate sont maintenus ensemble par des liaisons ioniques, donnant au composé sa structure cristalline caractéristique.
| Apparence | Poudre cristalline blanche ou petits cristaux blancs |
| Gravité spécifique | 2,54 g/cm³ |
| Couleur | Blanc |
| Odeur | Inodore |
| Masse molaire | 106,0 g/mole |
| Densité | 2,54 g/ml |
| Point de fusion | 851°C |
| Point d’ébullition | 1 600 °C |
| Point d’éclair | N’est pas applicable |
| Solubilité dans l’eau | Soluble dans l’eau |
| Solubilité | Soluble dans le glycérol, légèrement soluble dans l’éthanol |
| La pression de vapeur | Pas disponible |
| Densité de vapeur | Pas disponible |
| pKa | 10.3 |
| pH | 11,6 (solution 1M) |
Sécurité et dangers du carbonate de sodium
Le carbonate de sodium est un composé basique et peut provoquer une irritation de la peau et des yeux. L’inhalation de sa poussière peut provoquer une irritation respiratoire. Il est également nocif en cas d’ingestion et peut provoquer des troubles digestifs. La manipulation doit être effectuée avec des gants et des lunettes de protection, et la substance doit être stockée dans un endroit frais et sec, à l’écart des sources d’inflammation. Évitez d’ingérer ou d’inhaler la poudre et lavez-vous soigneusement après manipulation.
| Symboles de danger | XI, N |
| Description de la sécurité | Irritant |
| Numéros d’identification de l’ONU | ONU 1824 |
| Code SH | 2836.90.90 |
| Classe de danger | 8 |
| Groupe d’emballage | III |
| Toxicité | DL50 orale (rat) = 915 mg/kg. CL50 par inhalation (rat) = >10 mg/L/4h. Peut provoquer une irritation de la peau et des yeux, une irritation des voies respiratoires en cas d’inhalation. Peut être nocif en cas d’ingestion. |
Méthodes de synthèse du carbonate de sodium
Le carbonate de sodium peut être synthétisé par deux méthodes principales : le procédé Solvay et la méthode de précipitation. Le procédé Solvay, également connu sous le nom de procédé ammoniac-soude, implique la réaction du chlorure de sodium, de l’ammoniac et du dioxyde de carbone pour produire du carbonate de sodium, du chlorure d’ammonium et de l’eau. La méthode de précipitation implique la réaction de l’hydroxyde de sodium et du dioxyde de carbone pour produire du carbonate de sodium et de l’eau. Les deux méthodes aboutissent à un produit de haute pureté qui peut être utilisé pour diverses applications telles que le traitement de l’eau, la fabrication de savon et de détergents et la production de verre. Le procédé Solvay est la méthode la plus couramment utilisée en raison de son coût de production inférieur et de son rendement de production plus élevé.
Utilisations du carbonate de sodium
Les industries utilisent du carbonate de sodium ou de la lessive de soude, à diverses fins. L’industrie des détergents l’utilise comme adoucisseur d’eau et ajusteur de pH, l’industrie du verre l’utilise pour créer du verre plat, du verre d’emballage et du verre spécial, et l’industrie du papier l’utilise pour neutraliser les flux de déchets acides et ajuster le pH. Dans l’industrie chimique, le carbonate de sodium est un ingrédient clé dans la production de silicates et de bicarbonates de sodium. Il sert également d’additif alimentaire et d’agent nettoyant dans les chaudières et les processus de traitement de l’eau de l’industrie alimentaire. De plus, le carbonate de sodium joue un rôle dans la production de colorants, d’émaux, de céramiques et agit comme extincteur dans les extincteurs.
