Le carbonate de potassium (K2CO3) est une poudre blanche et inodore couramment utilisée dans la production de savon, de verre et de céramique. Il peut également être utilisé comme additif alimentaire et agent tampon dans l’industrie pharmaceutique.
| Nom de l’UICPA | Carbonate de potassium |
| Formule moléculaire | K2CO3 |
| Numero CAS | 584-08-7 |
| Synonymes | Acide carbonique, sel dipotassique ; Cendre perlée; Potasse; Sel de tartre ; Monocarbonate de potassium ; Carbonate acide de potassium |
| InChI | InChI=1S/CH2O3.2K/c2-1(3)4;;/h(H2,2,3,4);;/q;2*+1/p-2/fCO3.2K/q-2; m |
Propriétés du carbonate de potassium
Formule de carbonate de potassium
La formule chimique du carbonate de potassium est K2CO3. Cette formule représente le nombre exact d’atomes de chaque élément du composé. La formule peut être utilisée pour calculer la masse molaire et d’autres propriétés du composé.
Carbonate De Potassium Masse molaire
Le K2CO3 a une masse molaire de 138,21 g/mol. Cela signifie qu’une mole de K2CO3 contient 138,21 grammes du composé. La masse molaire est importante pour déterminer la quantité d’une substance nécessaire pour une réaction ou une expérience particulière. Il est également utilisé pour convertir la masse en moles d’une substance.
Point d’ébullition du carbonate de potassium
Le K2CO3 a un point d’ébullition relativement élevé de 1 620 °C (2 948 °F). Cela le rend utile dans les applications à haute température telles que la production de verre et de céramique. Le point d’ébullition est la température à laquelle une substance passe de l’état liquide à l’état gazeux.
Carbonate De Potassium Point De Fusion
Le K2CO3 a un point de fusion de 891°C (1 636°F). Ce point de fusion relativement élevé est dû à la nature ionique du composé. Lorsqu’elles sont chauffées, les liaisons ioniques entre les ions potassium et carbonate doivent être rompues pour que la substance fonde.
Densité du Carbonate de Potassium g/mL
La densité du K2CO3 est de 2,43 g/mL à température ambiante. Cela signifie qu’un certain volume de K2CO3 a une certaine masse. La densité d’une substance est une caractéristique importante qui peut être utilisée pour identifier la substance et calculer la masse ou le volume d’une substance dans un espace donné.
Carbonate De Potassium Poids moléculaire
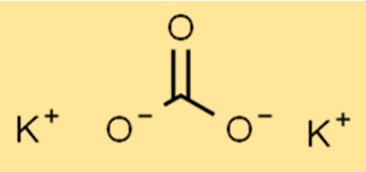
Le poids moléculaire du K2CO3 est de 138,21 g/mol. Il s’agit de la masse d’une mole du composé, qui est importante dans de nombreux calculs chimiques.
Structure du carbonate de potassium
K2CO3 a une structure ionique, avec une formule K2CO3. L’ion potassium (K+) et l’ion carbonate (CO32-) sont maintenus ensemble par des liaisons ioniques. L’ion carbonate est un ion polyatomique composé d’un atome de carbone et de trois atomes d’oxygène.
| Apparence | Poudre cristalline blanche |
| Densité spécifique | 2.43 |
| Couleur | Blanc |
| Odeur | Inodore |
| Masse molaire | 138,21 g/mole |
| Densité | 2,43 g/ml |
| Point de fusion | 891°C (1 636°F) |
| Point d’ébullition | 1 620 °C (2 948 °F) |
| Point d’éclair | N’est pas applicable |
| Solubilité dans l’eau | 112 g/100 mL à 20°C |
| Solubilité | Soluble dans l’eau, le glycérol et l’alcool |
| La pression de vapeur | Négligeable à température ambiante |
| Densité de vapeur | N’est pas applicable |
| pKa | 10h33 |
| pH | 11,5 (solution aqueuse à 10 g/L) |
Sécurité et dangers du carbonate de potassium
Le K2CO3 est généralement considéré comme sûr pour une utilisation dans l’industrie et dans les produits ménagers. Cependant, elle peut être irritante pour la peau et les yeux, et l’inhalation de la poudre peut provoquer une irritation des voies respiratoires. Une exposition prolongée à des concentrations élevées de poussière de K2CO3 peut provoquer des lésions pulmonaires. Il est important de porter un équipement de protection individuelle approprié lors de la manipulation de ce composé, notamment des gants, des lunettes et un masque. Le K2CO3 n’est ni inflammable ni explosif, mais il peut réagir avec les acides pour produire du dioxyde de carbone, ce qui peut être dangereux dans les espaces confinés. En cas d’ingestion ou de contact avec la peau ou les yeux, consulter immédiatement un médecin.
| Symboles de danger | Aucun |
| Description de la sécurité | Portez des gants, des lunettes et un masque. Évitez tout contact prolongé avec la peau et les yeux. Ne pas inhaler la poudre. |
| Numéros d’identification de l’ONU | UN1863 |
| Code SH | 2836.40.00 |
| Classe de danger | Non dangereux |
| Groupe d’emballage | N’est pas applicable |
| Toxicité | Le carbonate de potassium n’est pas considéré comme toxique, mais il peut provoquer une irritation respiratoire et cutanée à des concentrations élevées. Une exposition prolongée à des concentrations élevées de poussière peut provoquer des lésions pulmonaires. |
Méthodes de synthèse du carbonate de potassium
Diverses méthodes peuvent synthétiser le K2CO3
Une méthode courante consiste à faire réagir l’hydroxyde de potassium avec du dioxyde de carbone.
Pour empêcher la fuite de dioxyde de carbone, on peut effectuer cette réaction dans un récipient fermé.
Une autre méthode consiste à faire réagir du chlorure de potassium avec du carbonate de sodium dans une solution aqueuse. Le K2CO3 résultant précipite hors de la solution et peut être collecté par filtration.
Une autre façon de synthétiser le K2CO3 consiste à faire réagir le sulfate de potassium avec du carbone en présence de charbon de bois. Historiquement, les chimistes utilisaient le procédé Leblanc pour produire du K2CO3 à l’échelle industrielle. Cependant, les préoccupations environnementales ont rendu ce processus rare aujourd’hui, car il libère du dioxyde de soufre.
On peut synthétiser le K2CO3 à partir du bicarbonate de potassium en le chauffant à haute température, ce qui entraîne sa décomposition en K2CO3 et en dioxyde de carbone. Un four ou un four peut effectuer cette réaction.
Utilisations du carbonate de potassium
Le K2CO3 a un large éventail d’applications dans diverses industries en raison de ses propriétés uniques. Certaines de ses utilisations courantes incluent :
- Production de verre : utilisé comme flux pour abaisser le point de fusion de la silice et d’autres ingrédients.
- Industrie alimentaire : Utilisé comme additif alimentaire pour réguler l’acidité et comme agent levant en pâtisserie.
- Savon et détergents : Également utilisé dans la fabrication de savons et de détergents comme adoucisseur d’eau.
- Industrie pharmaceutique : Utilisé comme agent tampon dans la formulation de médicaments.
- Engrais : Également utilisé comme engrais en agriculture pour fournir du potassium aux plantes.
- Production de céramique : Utilisé comme flux pour réduire la température de cuisson et améliorer la qualité du produit fini.
- Feux d’artifice : Utilisé dans la production de feux d’artifice pour produire une flamme violette.
- Piles : utilisées dans la production de piles comme électrolyte.
- Industrie textile : Utilisé comme agent de teinture.
Des questions:
Q : Le carbonate de potassium est-il soluble ?
R : Oui, le carbonate de potassium est soluble dans l’eau.
Q : Le K2CO3 est-il soluble dans l’eau ?
R : Oui, le K2CO3 est soluble dans l’eau. En fait, il est très soluble et peut se dissoudre dans l’eau pour former une solution claire et incolore.
Q : Combien de grammes de carbonate de potassium faut-il pour préparer 200 ml d’une solution 2,5 M ?
R : Pour préparer une solution 2,5 M de K2CO3 dans 200 ml d’eau, vous devrez dissoudre 33,25 grammes de K2CO3 dans l’eau.
Calcul : Molarité = moles / volume (en litres) 2,5 M = moles / 0,2 L moles = 0,5 mole masse = moles x masse molaire masse = 0,5 mole x 138,21 g/mol masse = 33,25 g
Q : Quelle est la concentration d’ions K dans une solution de K2CO3 0,045 M en supposant une dissociation complète ?
R : Lorsque le K2CO3 est complètement dissocié dans l’eau, il forme deux ions K+ et un ion CO3 2-. Par conséquent, la concentration d’ions K+ dans une solution de K2CO3 à 0,045 M serait le double de la molarité de la solution de K2CO3, qui est de 0,090 M.
