Le carbonate de nickel (NiCO3) se forme à partir des ions nickel et des ions carbonate. C’est un solide vert utilisé dans les céramiques et les catalyseurs en raison de ses propriétés uniques.
| Nom UICPA | Carbonate de nickel(II) |
| Formule moléculaire | NiCO3 |
| Numero CAS | 3333-67-3 |
| Synonymes | Carbonate de nickel ; Acide carbonique, sel de nickel, monocarbonate de nickel |
| InChI | InChI=1S/CH2O3.Ni/c2-1(3)4;/h(H2,2,3,4);/q;+2 |
Propriétés du carbonate de nickel
Formule de carbonate de nickel
La formule chimique du monocarbonate de nickel est NiCO3. Il se compose d’un atome de nickel (Ni), d’un atome de carbone (C) et de trois atomes d’oxygène (O).
Carbonate De Nickel Masse molaire
La masse molaire du monocarbonate de nickel (NiCO3) est d’environ 118,7 grammes par mole. Cette valeur est obtenue en sommant les masses atomiques de ses éléments constitutifs.
Point d’ébullition du carbonate de nickel
Le monocarbonate de nickel n’a pas de point d’ébullition distinct car il a tendance à se décomposer avant d’atteindre le point d’ébullition. Lorsqu’il est chauffé, il se décompose en oxyde de nickel, dioxyde de carbone et oxygène.
Carbonate De Nickel Point de fusion
Le monocarbonate de nickel a un point de fusion d’environ 200°C (392°F). A cette température, il passe de l’état solide à l’état liquide.
Densité du carbonate de nickel g/mL
La densité du monocarbonate de nickel est d’environ 3,6 grammes par centimètre cube (g/cm³). Cette valeur de densité indique la masse du composé par unité de volume.
Carbonate De Nickel Poids moléculaire
Le poids moléculaire du monocarbonate de nickel (NiCO3) est d’environ 118,7 grammes par mole. Il est calculé en additionnant les poids atomiques de ses atomes constitutifs.
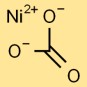
Structure du carbonate de nickel
Le monocarbonate de nickel a une structure de base dans laquelle un atome central de nickel est lié à trois atomes d’oxygène selon une disposition triangulaire. Cela forme le noyau de l’ion carbonate. La structure est maintenue ensemble par des liaisons ioniques et covalentes.
Solubilité du carbonate de nickel
Le monocarbonate de nickel est peu soluble dans l’eau. Sa solubilité augmente à mesure que le pH de la solution diminue. Il peut également se dissoudre dans des solutions acides contenant des substances comme l’acide chlorhydrique.
Les propriétés du monocarbonate de nickel le rendent utile dans diverses applications. Son insolubilité dans l’eau le rend adapté aux applications dans les céramiques et les pigments. Sa décomposition à haute température contribue à son utilisation dans les procédés catalytiques.
| Apparence | Solide vert |
| Gravité spécifique | 3,6 g/cm³ |
| Couleur | Vert |
| Odeur | Inodore |
| Masse molaire | 118,7 g/mole |
| Densité | 3,6 g/cm³ |
| Point de fusion | 200°C (392°F) |
| Point d’ébullition | Se décompose avant de bouillir |
| Point d’éclair | N’est pas applicable |
| Solubilité dans l’eau | Peu soluble |
| Solubilité | Soluble dans les acides comme l’acide chlorhydrique |
| Pression de vapeur | Pas disponible |
| Densité de vapeur | Pas disponible |
| pKa | N’est pas applicable |
| pH | N’est pas applicable |
Sécurité et dangers du carbonate de nickel
Le monocarbonate de nickel présente des risques potentiels pour la sécurité. Il peut irriter la peau et les yeux au contact, provoquant des rougeurs et un inconfort. L’inhalation de ses poussières ou de ses vapeurs peut entraîner une irritation des voies respiratoires ou de la toux. Il est conseillé de le manipuler avec précaution, en portant des équipements de protection appropriés comme des gants et des lunettes. Évitez d’ingérer ou d’inhaler le composé. En cas d’exposition, laver les zones touchées et consulter un médecin si les symptômes persistent. Une ventilation adéquate et des mesures de confinement sont essentielles pour minimiser les risques. Le respect des protocoles de sécurité lorsque vous travaillez avec du monocarbonate de nickel est crucial pour prévenir les problèmes de santé potentiels et garantir un environnement sûr.
| Symboles de danger | Irritant, Danger pour la santé |
| Description de la sécurité | Irritant; Éviter le contact et l’inhalation ; Manipuler avec soin |
| Numéros d’identification de l’ONU | Non attribué |
| Code SH | 2836.40.00 |
| Classe de danger | Non classés |
| Groupe d’emballage | Non classés |
| Toxicité | Peut provoquer une irritation de la peau et des yeux ; irritation respiratoire en cas d’inhalation |
Méthodes de synthèse du carbonate de nickel
Le monocarbonate de nickel peut être synthétisé par diverses méthodes. Une approche courante implique la réaction entre un sel de nickel soluble (tel que le chlorure de nickel ou le sulfate de nickel ) et un sel de carbonate soluble (comme le carbonate de sodium) dans l’eau. Les deux solutions sont mélangées, conduisant à la formation de monocarbonate de nickel insoluble sous forme de précipité vert. Ce précipité est ensuite filtré, lavé et séché pour obtenir le produit final.
Une autre méthode implique la réaction entre l’oxyde de nickel ou l’hydroxyde de nickel et le dioxyde de carbone gazeux en présence d’humidité. Cela entraîne la formation de monocarbonate de nickel avec de l’eau. Ce procédé est souvent utilisé industriellement pour produire du monocarbonate de nickel.
De plus, un procédé de précipitation peut être utilisé en mélangeant une solution d’un sel de nickel soluble avec une solution d’un sel de carbonate soluble. Le mélange résultant est agité et le précipité de monocarbonate de nickel formé est collecté et traité.
Ces méthodes de synthèse permettent de produire du monocarbonate de nickel pour diverses applications telles que les céramiques, les catalyseurs et les pigments. Un contrôle minutieux des conditions de réaction et des étapes de purification est crucial pour obtenir des produits à base de monocarbonate de nickel de haute qualité.
Utilisations du carbonate de nickel
Le monocarbonate de nickel trouve diverses applications en raison de ses propriétés uniques. Certaines utilisations importantes incluent :
- Production de céramique et de verre : le monocarbonate de nickel rehausse la céramique et le verre avec des couleurs vives pour l’expression artistique et l’usage industriel.
- Catalyseur : Il sert de catalyseur ou de précurseur de catalyseur dans divers processus chimiques, facilitant les réactions d’oxydation grâce à la libération d’oxygène lors de la décomposition à des températures élevées.
- Galvanoplastie : L’utilisation du monocarbonate de nickel comme précurseur permet la galvanoplastie du nickel sur diverses surfaces, renforçant ainsi l’apparence de la surface et la résistance à la corrosion.
- Industrie des batteries : dans les technologies de batteries, en particulier celles à base de nickel, elle contribue aux matériaux cathodiques, soutenant ainsi l’avancement des systèmes de batteries.
- Pigments et encres : le monocarbonate de nickel fait partie intégrante de la production d’un spectre de teintes vertes dans les pigments, les encres et les peintures.
- Agriculture : Son application comme source de nickel nutritif dans les engrais profite à la croissance des plantes et est utilisée en agriculture.
- Médecine : bien que cela soit rare, les chercheurs explorent les applications médicales potentielles dues à certains composés du nickel, notamment le monocarbonate de nickel, démontrant des propriétés antimicrobiennes.
- Photographie : Historiquement, elle a trouvé un rôle dans les toners de la photographie en noir et blanc, enrichissant les nuances et les contrastes.
- Textiles : L’industrie textile utilise du monocarbonate de nickel pour améliorer l’absorption des colorants et infuser de la couleur aux tissus.
- Recherche et éducation : les attributs chimiques du monocarbonate de nickel établissent son importance dans les laboratoires de chimie à des fins de démonstrations pédagogiques, d’expériences et de recherche.
Ces applications polyvalentes démontrent l’importance du monocarbonate de nickel dans diverses industries, depuis l’amélioration de l’esthétique des céramiques jusqu’au rôle joué dans des technologies de pointe telles que les batteries et les catalyseurs.
Des questions:
Q : Quel élément est le plus réactif ?
R : Sodium.
Q : Quel matériau utile est fabriqué en mélangeant du fer avec du chrome, du carbone et du nickel ?
R : Acier inoxydable.
Q : Le carbonate de nickel est-il soluble dans l’eau ?
R : Peu soluble.
Q : Combien de moles de carbone y a-t-il dans le nickel tétracarbonyle ?
R : Quatre grains de beauté.
Q : Comment enlever le nickelage de l’acier au carbone ?
R : En utilisant des agents de décapage chimiques appropriés ou des méthodes électrochimiques.
Q : Équation ionique nette du nitrate de nickel (II) et du carbonate de sodium ?
A : Ni²⁺ + CO₃²⁻ → NiCO₃(s).
Q : Rôle du monoxyde de carbone dans l’extraction du nickel ?
R : Il agit comme un agent réducteur pour extraire le nickel de ses minerais.
Q : Solubilité du monocarbonate de nickel ?
R : Faible solubilité dans l’eau.
Q : Numéros atomiques du carbone, du sodium et du nickel ?
A : Carbone : 6, Sodium : 11, Nickel : 28.
Q : Que se passe-t-il lorsque vous mélangez du carbonate d’ammonium, du chlorure de nickel et de l’eau ?
A : Formation de précipité de monocarbonate de nickel et libération de chlorure d’ammonium gazeux.
