Le carbonate de magnésium (MgCO3) est une substance poudreuse blanche couramment utilisée comme antiacide et laxatif. On le retrouve également dans certains cosmétiques et dentifrices. Le carbonate de magnésium aide à neutraliser l’excès d’acide gastrique et à soulager la constipation.
| Nom de l’UICPA | Carbonate de magnésium |
| Formule moléculaire | MgCO3 |
| Numero CAS | 546-93-0 |
| Synonymes | Magnésite, Magnesia carbonica, sel de magnésium, (MgCO3) |
| InChI | InChI=1S/CH2O3.Mg/c2-1(3)4;/h(H2,2,3,4);/q;+2 |
Propriétés du carbonate de magnésium
Formule de carbonate de magnésium
La formule chimique du carbonate de magnésium est MgCO3. Cette formule indique que le carbonate de magnésium contient un ion Mg+2 et un ion CO3 2-. L’ion CO3 2- est composé d’un atome de C et de trois atomes d’O. La formule chimique du carbonate de magnésium est une propriété importante car elle identifie la composition du carbonate de magnésium et ses éléments constitutifs.
Carbonate De Magnésium Masse molaire
La masse molaire du MgCO3 est de 84,31 g/mol. Cette valeur est obtenue en additionnant les masses atomiques des atomes de magnésium, de carbone et d’oxygène dans une mole de MgCO3. La masse molaire est une propriété physique importante du MgCO3 car elle est utilisée dans divers calculs tels que la détermination du nombre de moles de MgCO3 dans un échantillon donné.
Point d’ébullition du carbonate de magnésium
Le MgCO3 n’a pas de point d’ébullition défini car il se décompose avant d’atteindre son point d’ébullition. Lorsqu’il est chauffé, le MgCO3 se décompose pour former de l’oxyde de magnésium et du dioxyde de carbone. La décomposition du MgCO3 se produit à une température d’environ 350 °C.
Carbonate de magnésium Point de fusion
Le point de fusion du MgCO3 est de 990 °C. À cette température, le MgCO3 fond et subit une décomposition pour former de l’oxyde de magnésium et du dioxyde de carbone. Le point de fusion du MgCO3 est une propriété physique importante car il détermine la température à laquelle le MgCO3 peut être fondu et traité.
Densité du Carbonate de Magnésium g/mL
La densité du MgCO3 est de 2,958 g/mL. Cette valeur est obtenue en divisant la masse d’une mole de MgCO3 par son volume. La densité du MgCO3 est une propriété physique importante car elle est utilisée dans diverses applications telles que la détermination de la flottabilité du MgCO3 dans une solution donnée.
Carbonate De Magnésium Poids moléculaire
Le poids moléculaire du MgCO3 est de 84,31 g/mol. Cette valeur est obtenue en additionnant les masses atomiques des atomes de magnésium, de carbone et d’oxygène dans une molécule de MgCO3. Le poids moléculaire du MgCO3 est une propriété physique importante car il est utilisé dans divers calculs tels que la détermination de la quantité de MgCO3 requise pour une réaction chimique donnée.
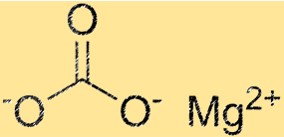
Structure du carbonate de magnésium
Le MgCO3 a une structure cristalline trigonale. L’ion magnésium est situé au centre de la structure et est entouré de six ions carbonate. Les ions carbonate sont disposés selon un motif hexagonal autour de l’ion magnésium. La structure cristalline du MgCO3 est une propriété importante car elle détermine ses propriétés physiques et chimiques.
| Apparence | Solide blanc |
| Densité spécifique | 2,958 g/ml |
| Couleur | Blanc |
| Odeur | Inodore |
| Masse molaire | 84,31 g/mole |
| Densité | 2,958 g/ml |
| Point de fusion | 990 °C |
| Point d’ébullition | Se décompose avant d’atteindre le point d’ébullition |
| Point d’éclair | N’est pas applicable |
| Solubilité dans l’eau | 0,02 g/L (15 °C) |
| Solubilité | Soluble dans les acides, insoluble dans l’eau |
| La pression de vapeur | N’est pas applicable |
| Densité de vapeur | N’est pas applicable |
| pKa | 10.3 |
| pH | 9.2-10.2 |
Sécurité et dangers du carbonate de magnésium
Le MgCO3 est considéré comme un composé sûr. Ce n’est pas inflammable, explosif ou toxique. Cependant, comme tout autre composé chimique, il doit être manipulé avec précaution. L’inhalation de poussière de MgCO3 peut provoquer une irritation respiratoire. Lors de la manipulation du MgCO3, il est recommandé de porter un équipement de protection individuelle approprié tel que des gants et des lunettes de sécurité. Le MgCO3 doit être stocké dans un endroit frais et sec, à l’écart des sources de chaleur et d’ignition. Le MgCO3 déversé doit être nettoyé immédiatement et éliminé correctement. Il est important de suivre les précautions de sécurité appropriées lors de la manipulation du MgCO3 pour éviter tout danger potentiel.
| Symboles de danger | Aucun |
| Description de la sécurité | Non classé comme dangereux |
| Numéros d’identification de l’ONU | N’est pas applicable |
| Code SH | 2836.60.00 |
| Classe de danger | Non classé comme dangereux |
| Groupe d’emballage | N’est pas applicable |
| Toxicité | Faible toxicité, n’est pas considéré comme un risque important pour la santé lorsqu’il est manipulé correctement |
Méthodes de synthèse du carbonate de magnésium
Il existe plusieurs méthodes pour synthétiser le MgCO3, notamment la précipitation et la décomposition thermique.
Pour former du MgCO3 à l’aide de la méthode de précipitation, vous ajoutez un sel de magnésium soluble (tel que le chlorure de magnésium ou le nitrate de magnésium) à une solution contenant un carbonate soluble (tel que le carbonate de sodium ou le carbonate d’ammonium). Ensuite, remuez le mélange obtenu et laissez-le reposer. Cela provoque la précipitation du MgCO3 hors de la solution. Après cela, filtrez le précipité, lavez-le et séchez-le.
Pour obtenir du MgCO3 par la méthode de décomposition thermique, on chauffe de l’hydroxyde de magnésium ou de l’oxyde de magnésium tout en introduisant du dioxyde de carbone. Cette réaction conduit à la formation de MgCO3 et de vapeur d’eau. L’étape suivante consiste à collecter, purifier et sécher le MgCO3.
Une autre méthode pour synthétiser le MgCO3 consiste à faire réagir le sulfate de magnésium et le carbonate de sodium . L’eau dissout les deux composés puis les mélange, provoquant la précipitation du MgCO3 hors de la solution. Le processus collecte, lave et sèche ensuite le précipité.
Utilisations du carbonate de magnésium
Le MgCO3 est un composé polyvalent avec diverses utilisations dans différentes industries. Voici quelques-unes de ses utilisations :
- Complément alimentaire : Utilisé comme complément alimentaire en raison de sa capacité à apporter à l’organisme le magnésium essentiel.
- Antiacide : utilisé comme antiacide pour traiter les brûlures d’estomac et l’indigestion.
- Applications industrielles : Utilisé dans plusieurs applications industrielles, comme dans la production de céramique, de verre et de ciment.
- Cosmétiques : Utilisé en cosmétique comme agent gonflant, absorbant et opacifiant.
- Ignifugation : Utilisé comme ignifuge dans plusieurs applications, notamment les matériaux isolants, les textiles et les plastiques.
- Produits pharmaceutiques : utilisés dans la production de divers produits pharmaceutiques, tels que des laxatifs et des antiacides.
- Industrie agroalimentaire : Utilisé comme additif alimentaire pour réguler l’acidité des produits alimentaires et comme agent antiagglomérant.
- Équipement sportif : utilisé dans les équipements sportifs, tels que la craie de gymnastique, pour améliorer l’adhérence et éviter de glisser.
Des questions:
Q : Le carbonate de magnésium est-il soluble dans l’eau ?
R : Le MgCO3 a une faible solubilité dans l’eau. À température ambiante, seulement 0,02 gramme environ de MgCO3 peut se dissoudre dans 100 ml d’eau.
Q : Le MgCO3 est-il soluble ?
R : Le MgCO3 a une faible solubilité dans l’eau, ce qui signifie qu’il n’est pas très soluble.
Q : Que se forme lorsque l’acide acétique et le MgCO3 réagissent ?
R : Lorsque l’acide acétique et le MgCO3 réagissent, ils forment de l’acétate de magnésium, de l’eau et du dioxyde de carbone. L’équation chimique équilibrée de cette réaction est MgCO3 + 2CH3COOH → Mg(CH3COO)2 + H2O + CO2.
Q : La solubilité molaire du MgCO3 est de 1,8 × 10–4 mol/L. Qu’est-ce que Ksp pour ce composé ?
A : Valeur Ksp pour MgCO3 en utilisant la solubilité molaire :
Ksp = [Mg2+][CO32-], où [Mg2+] est égal à la solubilité molaire, et [CO32-] est également égal à la solubilité molaire. Par conséquent, Ksp = (1,8 × 10–4 mol/L)2 = 3,24 × 10–9.
Q : Lequel des éléments suivants est un produit formé lors de la décomposition du MgCO3 ?
R : Lorsque le MgCO3 se décompose, il forme de l’oxyde de magnésium (MgO) et du dioxyde de carbone (CO2).
Q : Quelle est l’équation chimique équilibrée de la réaction utilisée pour calculer ΔH°f de MgCO3(s) ?
R : L’équation chimique équilibrée de la réaction utilisée pour calculer l’enthalpie standard de formation (ΔH°f) de MgCO3(s) est : Mg(s) + CO2(g) → MgCO3(s).
