Le carbonate de lithium (Li2CO3) est un composé essentiel utilisé dans les médicaments stabilisateurs de l’humeur. Il traite le trouble bipolaire et aide à gérer efficacement la dépression, favorisant ainsi le bien-être mental général.
| Nom UICPA | Carbonate de lithium |
| Formule moléculaire | Li2CO3 |
| Numero CAS | 554-13-2 |
| Synonymes | Carbonate de dilithium ; Acide carbonique, sel de dilithium ; Carbonate de lithium(1+); Acide carbonique, sel de lithium (1:1) |
| InChI | InChI=1S/CH2O3.2Li/c2-1(3)4;;/h(H2,2,3,4);;/q;2*+1/p-2 |
Propriétés du carbonate de lithium
Formule de carbonate de lithium
La formule du carbonate de dilithium est Li2CO3. Cela signifie que chaque molécule contient deux atomes de lithium (Li), un atome de carbone (C) et trois atomes d’oxygène (O). Cette composition chimique joue un rôle crucial dans ses propriétés et ses applications.
Carbonate De Lithium Masse molaire
La masse molaire du carbonate de dilithium est d’environ 73,89 g/mol. Il est calculé en additionnant les masses atomiques de ses éléments constitutifs, en considérant leurs proportions respectives dans la formule. Cette valeur est essentielle pour divers calculs chimiques et réactions impliquant le carbonate de dilithium.
Point d’ébullition du carbonate de lithium
Le carbonate de dilithium a un point d’ébullition élevé, généralement autour de 1 310 degrés Celsius (2 390 degrés Fahrenheit). À cette température, le composé se transforme de liquide en gaz, ce qui le rend adapté à des processus et applications industriels spécifiques.
Carbonate de lithium Point de fusion
Le carbonate de dilithium a un point de fusion relativement bas, généralement autour de 720 degrés Celsius (1 328 degrés Fahrenheit). À cette température, le composé passe d’un solide à un liquide, facilitant son utilisation dans la fabrication de céramiques, de verre et d’autres matériaux.
Densité du carbonate de lithium g/mL
La densité du carbonate de dilithium est d’environ 2,11 g/mL. Cette valeur représente sa masse par unité de volume, indiquant à quel point les particules sont serrées les unes contre les autres. La densité du carbonate de dilithium est cruciale pour comprendre ses propriétés physiques et son comportement.
Carbonate De Lithium Poids moléculaire
Le carbonate de dilithium a un poids moléculaire d’environ 73,89 g/mol. Cette valeur correspond à la masse d’une mole du composé et est essentielle dans divers calculs chimiques, tels que la détermination du nombre de moles dans une quantité donnée de substance.
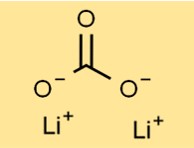
Structure du carbonate de lithium
Le carbonate de dilithium a une structure cristalline formant une poudre blanche et inodore. Son arrangement est constitué de cations Li+ et d’anions carbonate (CO3^2-) maintenus ensemble par des liaisons ioniques. Cette disposition spécifique contribue à la stabilité et à la réactivité du composé.
Solubilité du carbonate de lithium
Le carbonate de dilithium présente une solubilité limitée dans l’eau. Il se dissout dans une certaine mesure, formant une solution légèrement alcaline. La solubilité du carbonate de dilithium est une considération essentielle dans les formulations pharmaceutiques et autres applications où une dissolution contrôlée est requise.
| Apparence | Poudre blanche et inodore |
| Gravité spécifique | 2,11 g/ml |
| Couleur | Blanc |
| Odeur | Inodore |
| Masse molaire | 73,89 g/mole |
| Densité | 2,11 g/ml |
| Point de fusion | 720 °C (1 328 °F) |
| Point d’ébullition | 1 310 °C (2 390 °F) |
| Point d’éclair | N’est pas applicable |
| Solubilité dans l’eau | Solubilité limitée |
| Solubilité | Soluble dans l’eau, formant une solution légèrement alcaline |
| La pression de vapeur | Pas disponible |
| Densité de vapeur | Pas disponible |
| pKa | Pas disponible |
| pH | Légèrement alcalin |
Sécurité et dangers du carbonate de lithium
Le carbonate de dilithium présente des risques potentiels pour la sécurité qui nécessitent une manipulation prudente. Le contact direct avec la peau peut provoquer une irritation, tandis que l’ingestion peut entraîner un inconfort gastro-intestinal. En cas d’exposition excessive, cela peut déclencher des effets néfastes sur le système nerveux. Des précautions de sécurité appropriées, telles que le port d’un équipement de protection, doivent être suivies lors de sa manipulation pour éviter les risques potentiels. Il est crucial de stocker et de transporter le carbonate de dilithium à l’écart des substances incompatibles et des sources de chaleur ou de flammes. Dans les situations d’urgence, consultez immédiatement un médecin. Les fiches de données de sécurité et les directives doivent être soigneusement examinées et respectées lorsque vous travaillez avec du carbonate de dilithium.
| Symboles de danger | Corrosif, Irritant |
| Description de la sécurité | Peut provoquer une irritation. Évitez d’ingérer. Utiliser avec une ventilation adéquate. Portez un équipement de protection. |
| Numéros d’identification de l’ONU | N’est pas applicable |
| Code SH | 2836.40.00 |
| Classe de danger | Non classé comme dangereux |
| Groupe d’emballage | Non classés |
| Toxicité | Faible toxicité |
Méthodes de synthèse du carbonate de lithium
Différentes méthodes existent pour synthétiser le carbonate de dilithium.
Une approche courante consiste à soumettre des composés du lithium, comme l’hydroxyde de lithium ou l’oxyde de lithium, au dioxyde de carbone dans des conditions contrôlées. La réaction produit du carbonate de lithium et de l’eau comme sous-produit. Une autre méthode consiste à mélanger des sels de lithium solubles, tels que le chlorure de lithium, avec un composé carbonate soluble. La réaction forme un précipité solide de carbonate de lithium, que les chercheurs peuvent séparer et collecter.
De plus, il est possible de produire du carbonate de dilithium par décomposition thermique du bicarbonate de lithium. Lorsque le bicarbonate de lithium est chauffé, il se décompose en carbonate de lithium, libérant du dioxyde de carbone et de l’eau. Certains milieux industriels utilisent ce procédé pour obtenir du carbonate de lithium de haute pureté.
Pour atteindre les rendements et les niveaux de pureté souhaités, quelle que soit la méthode utilisée, ils doivent assurer un contrôle approprié des paramètres de réaction, tels que la température, la pression et la stœchiométrie. La synthèse du carbonate de dilithium joue un rôle essentiel dans la production de ce composé pour diverses applications, notamment les produits pharmaceutiques, les céramiques et les batteries.
Utilisations du carbonate de lithium
Le carbonate de dilithium trouve diverses applications en raison de ses propriétés uniques. Voici ses principales utilisations :
- Produits pharmaceutiques : C’est un composant essentiel des médicaments stabilisateurs de l’humeur, traitant efficacement le trouble bipolaire et la dépression et favorisant le bien-être mental.
- Batteries : dans les batteries rechargeables lithium-ion, le carbonate de dilithium sert de précurseur aux composés de lithium et joue un rôle crucial dans les technologies de stockage d’énergie.
- Pyrotechnie : la réaction exothermique du carbonate de dilithium avec certains produits chimiques le rend précieux dans les feux d’artifice et les fusées éclairantes.
- Synthèse chimique : En tant que source d’ions lithium, il est essentiel dans diverses réactions chimiques et synthèses organiques.
- Source de métaux alcalins : Il agit comme une source de lithium dans les laboratoires et la recherche, utilisé pour étudier les propriétés des métaux alcalins.
- Applications environnementales : le carbonate de dilithium aide à réguler le pH dans les processus de traitement de l’eau, en contrôlant l’acidité et l’alcalinité.
- Céramiques et verre : le carbonate de dilithium améliore la stabilité des produits céramiques et verriers en servant d’agent fondant, réduisant ainsi les températures de fusion.
- Métallurgie : En métallurgie, le carbonate de dilithium affine les métaux tels que l’aluminium et le cuivre, éliminant efficacement les impuretés et améliorant leurs propriétés mécaniques.
- Climatisation : Les déshydratants des systèmes de climatisation utilisent du carbonate de dilithium pour absorber efficacement l’humidité, garantissant ainsi des performances de climatisation optimales.
Dans l’ensemble, la large gamme d’applications du carbonate de dilithium met en évidence son importance dans tous les secteurs, ce qui en fait un composé précieux dans la technologie moderne, la médecine et les sciences des matériaux.
Des questions:
Q : Lequel des éléments suivants possède le moins d’électrons de valence ?
R : Le béryllium possède le moins d’électrons de valence, avec seulement deux.
Q : À quoi sert le carbonate de lithium ?
R : Le carbonate de dilithium est utilisé dans les médicaments stabilisateurs de l’humeur pour traiter le trouble bipolaire et la dépression.
Q : Le carbonate de dilithium est-il soluble ?
R : Oui, le carbonate de dilithium est soluble dans l’eau dans une mesure limitée.
Q : Comment fonctionne le carbonate de lithium ?
R : Le carbonate de dilithium agit en stabilisant l’humeur et en équilibrant les neurotransmetteurs dans le cerveau.
Q : Que traite le carbonate de lithium ?
R : Le carbonate de dilithium est utilisé pour traiter le trouble bipolaire et la dépression en médecine psychiatrique.
Q : Le LiNO3 est-il ionique ou covalent ?
R : LiNO3 est ionique.
Q : Lequel des éléments suivants est insoluble dans l’eau ? Li2CO3, NaOH, PbCl2, Ba(OH)2, (NH4)2S.
R : PbCl2 et Ba(OH)2 sont insolubles dans l’eau.
Q : Le Li2CO3 est-il soluble dans l’eau ?
R : Li2CO3 est légèrement soluble dans l’eau.
Q : Combien d’ions y a-t-il dans Li2CO3 ?
R : Li2CO3 contient trois ions : deux ions Li+ et un ion CO3^2-.
Q : Combien d’unités de formule trouve-t-on dans 0,0067 g de Li2CO3 ?
R : Il y a environ 1,24 x 10^20 unités de formule dans 0,0067 g de Li2CO3.
Q : Combien d’ions lithium sont présents dans 30,0 ml de solution 0,600 M Li2CO3 ?
R : Il y a 0,036 mole d’ions Li+ dans 30,0 ml de solution Li2CO3 0,600 M.
Q : Quelle est la composition en pourcentage en masse de carbone dans le carbonate de lithium, Li2CO3 ?
R : La composition en pourcentage en masse de carbone dans Li2CO3 est d’environ 11,3 %.
Q : Laquelle des paires de solutions aqueuses suivantes formera un précipité lorsqu’on mélange NH4NO3 + Li2CO3 ?
R : NH4NO3 + Li2CO3 ne formeront pas de précipité puisque les deux composés sont solubles dans l’eau.
