Le carbonate de cuivre (CuCO3) est un composé bleu-vert formé naturellement par la réaction de sels de Cu avec des ions carbonate. Il a diverses applications industrielles, notamment les pigments et les fongicides.
| Nom UICPA | Carbonate de cuivre(II) |
| Formule moléculaire | CuCO3 |
| Numero CAS | 1184-64-1 |
| Synonymes | Carbonate de cuivre basique, Carbonate cuivrique, Monocarbonate de cuivre |
| InChI | InChI=1S/CH2O3.Cu/c2-1(3)4;/h(H2,2,3,4);/q;+2/p-2 |
Propriétés du carbonate de cuivre
Formule de carbonate de cuivre
La formule chimique du carbonate cuivrique est CuCO3. Il représente une combinaison d’un atome de cuivre (Cu), d’un atome de carbone (C) et de trois atomes d’oxygène (O). Cette formule fournit des informations cruciales sur la composition élémentaire du composé.
Carbonate De Cuivre Masse molaire
Le carbonate cuivrique a une masse molaire d’environ 123,55 grammes par mole (g/mol). La masse molaire est la somme des masses atomiques de tous les atomes présents dans une mole de substance et est exprimée en grammes par mole.
Point d’ébullition du carbonate de cuivre
Le carbonate cuivrique n’a pas de point d’ébullition distinct puisqu’il se décompose en CuO et en dioxyde de carbone lorsqu’il est chauffé à environ 200°C. Par conséquent, il subit une décomposition thermique plutôt que de l’ébullition.
Carbonate de cuivre Point de fusion
Le carbonate cuivrique a un point de fusion d’environ 200°C (392°F). A cette température, le carbonate cuivrique solide se transforme à l’état liquide. Il faut toutefois noter qu’il se décompose avant d’atteindre son point d’ébullition.
Densité du Carbonate de Cuivre g/mL
La densité du carbonate cuivrique est d’environ 3,6 grammes par millilitre (g/mL). La densité mesure la masse d’une substance par unité de volume, indiquant à quel point ses particules sont serrées les unes contre les autres.
Carbonate De Cuivre Poids moléculaire
Le poids moléculaire du carbonate cuivrique, également appelé masse molaire, est d’environ 123,55 g/mol. Cette valeur est cruciale pour divers calculs et conversions chimiques.
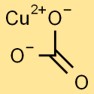
Structure du carbonate de cuivre
Le carbonate cuivrique adopte une structure planaire trigonale. L’atome central de cuivre est entouré de trois atomes d’oxygène et d’un groupe carbonate, composé d’un atome de carbone et de trois atomes d’oxygène liés ensemble.
Solubilité du carbonate de cuivre
Le carbonate cuivrique est peu soluble dans l’eau, ce qui signifie qu’il ne se dissout que dans une mesure limitée. La solubilité est affectée par des facteurs tels que la température et le pH. Il réagit avec les acides pour former des sels de cuivre et libérer du dioxyde de carbone.
| Apparence | Solide bleu-vert |
| Gravité spécifique | ~3,6 g/ml |
| Couleur | Bleu vert |
| Odeur | Inodore |
| Masse molaire | ~123,55 g/mole |
| Densité | ~3,6 g/ml |
| Point de fusion | ~200°C (392°F) |
| Point d’ébullition | Se décompose à ~200°C |
| Point d’éclair | N’est pas applicable |
| Solubilité dans l’eau | Peu soluble, affecté par la température et le pH |
| Solubilité | Insoluble dans la plupart des solvants |
| Pression de vapeur | N’est pas applicable |
| Densité de vapeur | N’est pas applicable |
| pKa | N’est pas applicable |
| pH | Alcaline (de base) |
Sécurité et dangers du carbonate de cuivre
Le carbonate cuivrique pose certaines considérations de sécurité et de danger. Il est essentiel de le manipuler avec précaution pour éviter les risques potentiels. Le contact direct avec la peau, les yeux ou l’inhalation de poussière peut provoquer une irritation et un inconfort. Une exposition ou une ingestion prolongée peut être nocive et entraîner des problèmes de santé plus graves. Il peut libérer des fumées toxiques, notamment du dioxyde de carbone, lorsqu’il est chauffé, nécessitant une ventilation adéquate. De plus, le carbonate cuivrique est inflammable sous forme de poudre, ce qui nécessite un stockage et une manipulation prudents pour éviter les risques d’incendie. Pour garantir la sécurité, suivez toujours les consignes de sécurité, portez un équipement de protection approprié et stockez le composé à l’écart des matériaux incompatibles.
| Symboles de danger | Irritant, Danger |
| Description de la sécurité | Manipuler avec soin. Évitez les contacts directs. Utiliser dans des zones bien ventilées. Suivez les consignes de sécurité et portez un équipement de protection. |
| Numéros d’identification de l’ONU | Non attribué |
| Code SH | 2836.40.0000 |
| Classe de danger | Non classés |
| Groupe d’emballage | N’est pas applicable |
| Toxicité | Faible toxicité ; peut provoquer une irritation et un inconfort au contact ; éviter l’ingestion et l’inhalation. |
Méthodes de synthèse du carbonate de cuivre
Il existe diverses méthodes pour synthétiser le carbonate cuivrique, impliquant toutes la combinaison de sels de Cu avec des sources de carbonate. Une approche courante consiste à faire réagir CuSO4 avec du carbonate de sodium (Na2CO3) dans une solution aqueuse. Cette réaction donne un précipité de carbonate cuivrique, et une filtration le sépare, suivie d’un séchage pour obtenir le produit solide.
Une autre méthode implique la réaction de CuCl2 avec du carbonate de sodium ou du bicarbonate de sodium (NaHCO3) dans un environnement aqueux similaire. Cette réaction produit du carbonate cuivrique et du chlorure de sodium (NaCl) comme sous-produit.
De plus, le fait de faire barboter du dioxyde de carbone (CO2) à travers une solution de Cu(OH)2 forme un précipité de carbonate cuivrique lors de la conversion de l’hydroxyde.
Le métal Cu interagit avec le dioxyde de carbone gazeux dans un environnement contrôlé pour produire du carbonate cuivrique.
Le contrôle des conditions de réaction, telles que la température et la concentration, devient crucial pour atteindre les rendements et la pureté souhaités. Ces méthodes offrent les moyens de produire du carbonate cuivrique pour diverses applications industrielles, notamment son utilisation comme pigment, fongicide ou dans d’autres procédés chimiques.
Utilisations du carbonate de cuivre
Le carbonate de cuivre trouve des applications polyvalentes dans diverses industries en raison de ses propriétés uniques. Voici quelques utilisations clés du carbonate cuivrique :
- Pigments : Le carbonate cuivrique confère largement des teintes bleu-vert vibrantes aux peintures, à la céramique et aux plastiques, améliorant ainsi leur apparence.
- Fongicide agricole : Il sert efficacement de fongicide en agriculture, protégeant les cultures des infections fongiques et favorisant une croissance saine des plantes.
- Préservation du bois : Le carbonate de cuivre est utilisé dans les formulations de préservation du bois, protégeant le bois de la pourriture et des dommages causés par les insectes.
- Galvanoplastie : elle facilite de manière cruciale les processus de galvanoplastie, permettant le dépôt d’un revêtement de cuivre sur diverses surfaces métalliques, améliorant ainsi la conductivité et la résistance à la corrosion.
- Catalyseur : Le carbonate cuivrique agit comme un catalyseur actif dans plusieurs réactions chimiques, accélérant les vitesses de réaction sans subir lui-même de changements significatifs.
- Algicide : Dans le traitement de l’eau, il fonctionne activement comme un algicide, contrôlant la croissance des algues dans les réservoirs, les étangs et les systèmes d’eau.
- Fabrication du verre : Le carbonate de cuivre contribue activement à la production de produits en verre teinté vert comme les bouteilles et la verrerie décorative dans l’industrie de la fabrication du verre.
- Bijoux artificiels : La production de bijoux artificiels intègre activement du carbonate cuivrique, offrant une alternative abordable aux véritables bijoux à base de cuivre.
- Chimie analytique : le carbonate de cuivre trouve un emploi actif comme réactif en chimie analytique pour mener divers tests et expériences.
- Feux d’artifice et pièces pyrotechniques : Il contribue activement à la couleur verte vive des feux d’artifice et des spectacles pyrotechniques.
La diversité des applications met en valeur l’importance du carbonate cuivrique en tant que composé chimique précieux dans de nombreuses industries, améliorant à la fois les produits et les processus.
Des questions:
Q : Combien de moles d’atomes d’oxygène y a-t-il dans 5,67 moles de carbonate de cuivre(II) ?
R : Dans 5,67 moles de carbonate de cuivre(II), il y a 17,01 moles d’atomes d’oxygène (3 atomes d’oxygène pour 1 mole de CuCO3).
Q : Le carbonate de cuivre est-il soluble ?
R : Le carbonate cuivrique est peu soluble dans l’eau.
Q : Quel élément est le plus susceptible de laisser passer l’électricité : le cuivre, le carbone, l’hélium ou le soufre ?
R : Le cuivre est l’élément le plus susceptible de laisser passer l’électricité, car c’est un bon conducteur d’électricité.
Q : Comment fabriquer du carbonate de cuivre ?
R : Le carbonate cuivrique peut être préparé en faisant réagir des sels de Cu avec des sources de carbonate, telles que le carbonate de sodium, ou en faisant barboter du dioxyde de carbone dans une solution de Cu(OH)2.
Q : Comment utiliser le carbonate de cuivre en poterie ?
R : Le carbonate cuivrique est utilisé en poterie comme glaçage céramique pour ajouter une couleur bleu-vert aux pièces finies.
Q : Le CuCO3 est-il soluble dans l’eau ?
R : Le CuCO3 est peu soluble dans l’eau.
Q : Comment pourriez-vous utiliser une réaction de précipitation pour préparer un échantillon de CuCO3 ?
R : Pour préparer du CuCO3 par une réaction de précipitation, vous pouvez mélanger un sel de Cu soluble avec un sel de carbonate soluble, conduisant à la formation de carbonate cuivrique insoluble, qui peut être séparé par filtration.
Q : Quel est le nom du composé CuCO3 ?
R : Le composé CuCO3 est appelé carbonate cuivrique (II).
Q : Quelle est la masse molaire du CuCO3 ?
R : La masse molaire du CuCO3 est d’environ 123,55 g/mol.
Q : Le CuCO3 est-il soluble ou insoluble ?
R : Le CuCO3 est insoluble dans la plupart des solvants, y compris l’eau.
Q : De quoi est composé le carbonate de cuivre(II) ?
R : Le carbonate de cuivre (II) est composé d’un atome de Cu, d’un atome de carbone (C) et de trois atomes d’oxygène (O).
