Le carbonate de calcium est un composé chimique de formule CaCO3. On le trouve couramment dans les roches et les coquillages et est utilisé dans la production de ciment, de peintures et de compléments alimentaires.
| Nom UICPA | Carbonate de calcium |
| Formule moléculaire | CaCO3 |
| Numero CAS | 471-34-1 |
| Synonymes | Calcaire, craie, calcite, aragonite, marbre, carbonate de calcium précipité, sel de calcium d’acide carbonique (1:1) |
| InChI | InChI=1S/CH2O3.Ca/c2-1(3)4;/h(H2,2,3,4);/q;+2/p-2 |
CaCO3 Masse molaire
La masse molaire du carbonate de calcium est de 100,09 g/mol. Cela signifie qu’une mole de carbonate de calcium contient 100,09 grammes du composé. La masse molaire est importante dans les calculs stœchiométriques car elle permet la conversion des moles en grammes ou vice versa.
Formule de carbonate de calcium
La formule chimique du carbonate de calcium est CaCO₃. Cela signifie que chaque molécule de carbonate de calcium contient un atome de calcium, un atome de carbone et trois atomes d’oxygène. La formule est importante pour déterminer la quantité de carbonate de calcium nécessaire pour une application spécifique et pour comprendre ses propriétés chimiques.
Point d’ébullition du carbonate de calcium
Le carbonate de calcium n’a pas de point d’ébullition car il se décompose avant d’atteindre son point d’ébullition. À pression atmosphérique, le carbonate de calcium se décompose en oxyde de calcium et en dioxyde de carbone à des températures supérieures à 825°C. Par conséquent, le carbonate de calcium est couramment utilisé dans les applications à haute température, comme dans la production de ciment.
Carbonate de Calcium Point de fusion
Le point de fusion du carbonate de calcium est de 1 339°C. À cette température, le carbonate de calcium subit une décomposition thermique pour former de l’oxyde de calcium et du dioxyde de carbone. Le point de fusion est important pour comprendre le comportement du carbonate de calcium à haute température.
Densité du Carbonate de Calcium g/ml
La densité du carbonate de calcium est de 2,71 g/cm³. Cela signifie que le carbonate de calcium est plus dense que l’eau et coulera lorsqu’il sera placé dans l’eau. La densité est importante pour comprendre les propriétés physiques du carbonate de calcium et pour déterminer ses utilisations dans diverses applications.
Carbonate De Calcium Poids moléculaire
Le poids moléculaire du carbonate de calcium est de 100,09 g/mol. Cela signifie que le composé est composé d’un atome de calcium, d’un atome de carbone et de trois atomes d’oxygène. Le poids moléculaire est important pour déterminer la quantité de carbonate de calcium nécessaire pour une application spécifique et pour comprendre ses propriétés chimiques.
Structure du carbonate de calcium
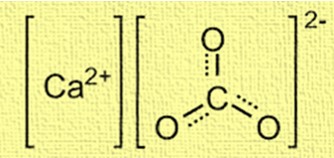
La structure du carbonate de calcium est cristalline et composée d’ions calcium (Ca²⁺) et d’ions carbonate (CO₃²⁻). Les ions calcium sont situés au centre de la structure et sont entourés de six ions carbonate. Les ions carbonate sont disposés selon une forme planaire trigonale, chaque atome d’oxygène étant connecté à l’atome de carbone par une double liaison. La structure est importante pour comprendre le comportement du carbonate de calcium dans diverses applications, telles que la formation de coquillages et de récifs coralliens.
| Apparence | Poudre blanche ou cristal incolore |
| Gravité spécifique | 2,71 |
| Couleur | Blanc |
| Odeur | Inodore |
| Masse molaire | 100,09 g/mole |
| Densité | 2,71 g/cm³ |
| Point de fusion | 1 339 °C |
| Point d’ébullition | Se décompose avant de bouillir |
| Point d’éclair | N’est pas applicable |
| Solubilité dans l’eau | 0,0013 g/100 ml (25 °C) |
| Solubilité | Insoluble dans l’eau et la plupart des solvants organiques |
| La pression de vapeur | Négligeable |
| Densité de vapeur | N’est pas applicable |
| pKa | 9h00 (premier); 11,8 (seconde) |
| pH | 9,3 – 9,7 (solution aqueuse 0,1 M) |
Sécurité et dangers du carbonate de calcium
Le carbonate de calcium est généralement considéré comme sans danger pour les humains et l’environnement lorsqu’il est utilisé selon les instructions. Cependant, l’inhalation de poussières de carbonate de calcium peut provoquer une irritation des voies respiratoires, des yeux et de la peau. Une exposition à long terme à des concentrations élevées de poussière de carbonate de calcium peut provoquer des lésions pulmonaires. Le carbonate de calcium peut également réagir avec des acides forts pour produire du dioxyde de carbone, ce qui peut provoquer un risque d’incendie ou d’explosion dans certaines situations. Il est important de suivre les procédures de sécurité appropriées lors de la manipulation du carbonate de calcium, comme porter un équipement de protection et assurer une ventilation adéquate.
| Symboles de danger | N’est pas applicable |
| Description de la sécurité | Eviter l’inhalation de poussière. Portez un équipement de protection. |
| Numéros d’identification de l’ONU | Non réglementé |
| Code SH | 2836.50.00 |
| Classe de danger | Non réglementé |
| Groupe d’emballage | N’est pas applicable |
| Toxicité | Faible toxicité pour l’homme et l’environnement |
Méthodes de synthèse du carbonate de calcium
Diverses méthodes peuvent synthétiser le carbonate de calcium (CaCo3), notamment les méthodes de précipitation, de carbonatation et sol-gel.
La méthode de précipitation consiste à mélanger de l’hydroxyde de calcium avec un sel de carbonate soluble, tel que le carbonate de sodium , dans des conditions contrôlées pour former un précipité de CaCo3. Pour obtenir le produit final, il faut filtrer et sécher le précipité.
La méthode de carbonatation consiste à faire réagir de l’oxyde de calcium avec du dioxyde de carbone sous haute pression et température pour produire du CaCo3. Il faut effectuer la réaction dans un système fermé pour empêcher la fuite de dioxyde de carbone. Ensuite, il faut séparer tout oxyde de calcium ou dioxyde de carbone n’ayant pas réagi du CaCo3 résultant et le purifier.
La méthode sol-gel implique l’hydrolyse et la condensation d’un précurseur contenant du calcium, tel que l’alcoolate de calcium ou le nitrate de calcium, en présence d’un solvant et d’un catalyseur. Pour produire du CaCo3, il faut sécher et calciner le gel obtenu.
La méthode de synthèse du CaCo3 implique l’utilisation de la biominéralisation, où des organismes vivants tels que les coraux ou les coquilles d’huîtres génèrent des cristaux de CaCo3. Les opérateurs collectent ces cristaux et les traitent pour obtenir le produit final.
Chaque méthode a ses propres avantages et inconvénients, et le choix de la méthode dépend de facteurs tels que le coût, la pureté et la taille des particules souhaitée pour le produit final.
Utilisations du carbonate de calcium
Le carbonate de calcium a de nombreuses utilisations dans diverses industries, en raison de ses propriétés telles qu’une faible toxicité, une pureté élevée et une disponibilité à faible coût. Certaines utilisations courantes du carbonate de calcium sont :
- Construction : Utilisé comme matériau de construction sous forme de calcaire, de marbre et de craie. Utilisé comme charge pour améliorer la résistance et la durabilité du ciment, du mortier et du béton.
- Produits pharmaceutiques : utilisés dans la production d’antiacides et de suppléments de calcium. Utilisé comme excipient lors de la formulation de comprimés et de gélules.
- Aliments et boissons : Utilisé comme additif alimentaire pour enrichir le calcium et comme ajusteur de pH dans les boissons.
- Papier et pâte à papier : Utilisé comme agent de remplissage et de revêtement dans la production de papier et de carton, pour améliorer l’imprimabilité et la blancheur.
- Plastiques : Utilisés comme agent de remplissage et de renforcement dans les produits en plastique, pour améliorer leurs propriétés mécaniques et réduire les coûts.
- Peintures et revêtements : Utilisé comme pigment et charge dans les peintures et revêtements, pour améliorer leur opacité et leur couverture.
- Agriculture : Utilisé comme amendement du sol pour améliorer la qualité du sol et la croissance des cultures.
- Traitement de l’eau : Utilisé pour neutraliser l’eau acide et éliminer les impuretés de l’eau.
Ce sont quelques-unes des utilisations les plus courantes du carbonate de calcium, mais il existe de nombreuses autres applications dans diverses industries.
Des questions:
Q : Le carbonate de calcium est-il soluble dans l’eau ?
R : Le carbonate de calcium a une faible solubilité dans l’eau, avec une solubilité d’environ 0,0013 g/100 mL à 25 °C.
Q : Qu’est-ce que le carbonate de calcium ?
R : Le carbonate de calcium est un composé chimique de formule CaCO3. C’est une substance courante que l’on trouve dans les roches, les coquilles d’organismes marins et dans divers gisements minéraux.
Q : Où peut-on trouver du carbonate de calcium ?
R : Le carbonate de calcium peut être trouvé dans diverses sources naturelles telles que le calcaire, la craie et le marbre. On le trouve également dans les coquilles d’organismes marins tels que les huîtres, les palourdes et les coraux.
Q : Le carbonate de calcium est-il ionique ou covalent ?
R : Le carbonate de calcium est un composé ionique composé d’un cation calcium (Ca2+) et d’un anion carbonate (CO32-).
Q : Le carbonate de calcium est un type de sédiment hydrogéné qui peut être enfoui et durci en _____.
R : Le carbonate de calcium est un type de sédiment hydrogéné qui peut être enfoui et durci en calcaire.
Q : Les structures en couches constituées de carbonate de calcium par les cyanobactéries précambriennes sont appelées _____.
R : Les structures en couches constituées de carbonate de calcium par les cyanobactéries précambriennes sont appelées stromatolites.
