Le carbonate d’ammonium ((NH4)2CO3) est un sel. Il se forme lorsque l’ammoniac et le dioxyde de carbone réagissent. Il a de nombreuses utilisations, comme la pâtisserie et le sel odorant.
| Nom de l’UICPA | Carbonate d’ammonium |
| Formule moléculaire | (NH4)2CO3 |
| Numero CAS | 506-87-6 |
| Synonymes | ammoniaque de boulanger, sel volatil, sel de hartshorn, E503 |
| InChI | InChI=1S/CH2O3.2H3N/c2-1(3)4;;/h(H2,2,3,4);2*1H3 |
Propriétés du carbonate d’ammonium
Formule de carbonate d’ammonium
La formule chimique ou formule moléculaire du carbonate d’ammonium est (NH4)2CO3 1 . C’est un sel composé de deux ions ammonium et d’un ion carbonate. Il peut s’écrire NH4+ + NH4+ + CO3 2- pour montrer les charges des ions.
Carbonate D’Ammonium Masse molaire
La masse molaire de (NH4)2CO3 est 96,09 g/mol 2 . Pour calculer la masse molaire, nous devons additionner les masses atomiques de tous les atomes de la formule. Les masses atomiques sont :
- Azote : 14,01 g/mol
- Hydrogène : 1,01 g/mol
- Carbone : 12,01 g/mol
- Oxygène : 16,00 g/mol
Ainsi, la masse molaire du carbonate d’ammonium est :
(2 x 14,01) + (8 x 1,01) + 12,01 + (3 x 16,00) = 96,09 g/mol
Point d’ébullition du carbonate d’ammonium
Le (NH4)2CO3 n’a pas de point d’ébullition car il se décompose avant d’atteindre cette température. Lorsqu’il est chauffé, il se décompose en ammoniac et en dioxyde de carbone, qui s’échappent du solide. La réaction de décomposition est :
(NH4)2CO3 -> 2NH3 + CO2 + H2O
La température de décomposition dépend de l’humidité et de la pression de l’environnement, mais elle se situe généralement autour de 60°C.
Carbonate d’ammonium Point de fusion
Le (NH4)2CO3 a un point de fusion de 58°C (136°F ; 331 K). Cependant, il se décompose également à cette température et ne forme donc pas de phase liquide. Au lieu de cela, il se sublime directement du solide au gaz.
Densité du Carbonate d’Ammonium g/ml
La densité du (NH4)2CO3 est de 1,50 g/ml. La densité est la masse par unité de volume d’une substance. Pour calculer la densité, il faut diviser la masse par le volume. Par exemple, si nous avons 10 g de (NH4)2CO3 et qu’il occupe 6,67 ml d’espace, alors la densité est :
10 g / 6,67 ml = 1,50 g/ml
Carbonate D’Ammonium Poids moléculaire
Le poids moléculaire du (NH4)2CO3 est le même que sa masse molaire, qui est de 96,09 g/mol. Le poids moléculaire et la masse molaire sont souvent utilisés de manière interchangeable, mais ils ont des significations légèrement différentes. Le poids moléculaire est la masse d’une molécule d’une substance, tandis que la masse molaire est la masse d’une mole (6,022 x 10 ^ 23 molécules) d’une substance.
Structure du carbonate d’ammonium
La structure du (NH4)2CO3 peut être représentée par une structure de points de Lewis ou un modèle boule-bâton. Une structure de points de Lewis montre les électrons de valence de chaque atome et comment ils sont partagés ou transférés pour former des liaisons. Un modèle en forme de boule et de bâton montre la forme et la disposition des atomes et des liaisons en trois dimensions.
Voici une structure de points de Lewis possible pour le carbonate d’ammonium :
OOOO
|| || ||
HNH HNH HCH
| | |
H H H
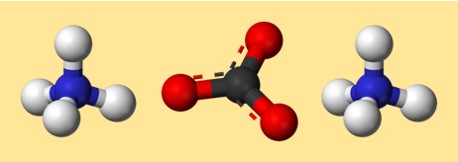
Voici un modèle possible pour le carbonate d’ammonium :
Dans ce modèle, chaque couleur représente un élément différent :
- Gris : carbone
- Rouge : oxygène
- Bleu : azote
- Blanc : hydrogène
Solubilité du carbonate d’ammonium
Le (NH4)2CO3 est soluble dans l’eau. La solubilité est la capacité d’une substance à se dissoudre dans une autre substance. Lorsque le (NH4)2CO3 se dissout dans l’eau, il forme des ions aqueux qui peuvent interagir avec d’autres ions ou molécules en solution. La réaction de dissolution est :
(NH4)2CO3 + H2O -> 2 NH4+ + CO3 2- + H2O
La solubilité du (NH4)2CO3 dépend de la température et du pH de l’eau. À des températures plus élevées, davantage de (NH4)2CO3 peut se dissoudre dans l’eau.
| Apparence | poudre blanche |
| Densité spécifique | 1,50 |
| Couleur | Incolore |
| Odeur | Odeur âcre d’ammoniaque |
| Masse molaire | 96,09 g/mole |
| Densité | 1,50 g/ml |
| Point de fusion | 58°C (136°F; 331K) |
| Point d’ébullition | Se décompose avant de bouillir |
| Point d’éclair | N’est pas applicable |
| Solubilité dans l’eau | 100 g/100 ml (15°C) |
| Solubilité | Soluble dans l’eau, l’alcool et l’acétone |
| Pression de vapeur | Pas disponible |
| Densité de vapeur | Pas disponible |
| pKa | 9,25 (pour NH4+) |
| pH | 7,8 (pour une solution 0,1 M) |
Sécurité et dangers du carbonate d’ammonium
Le (NH4)2CO3 est une substance dangereuse qui peut provoquer une irritation et des dommages à la peau, aux yeux, au nez, à la gorge et aux poumons. Cela peut également être nocif en cas d’ingestion. Il doit être manipulé avec précaution et avec un équipement de protection individuelle, tel que des gants, des lunettes et des masques. Il doit être stocké dans un endroit frais, sec et bien ventilé, à l’abri de la chaleur, des étincelles et des flammes. Il ne doit pas être mélangé avec des acides forts, des bases ou des agents réducteurs, car il pourrait réagir violemment ou libérer des gaz toxiques. En cas d’exposition, consulter immédiatement un médecin.
| Symboles de danger | Xi (Irritant) |
| Description de la sécurité | S22 : Ne respirez pas la poussière. S24/25 : Éviter le contact avec la peau et les yeux. |
| Numéros d’identification de l’ONU | UN3077 |
| Code SH | 28369910 |
| Classe de danger | 9 |
| Groupe d’emballage | III |
| Toxicité | DL50 orale rat : 2000 mg/kg |
Méthodes de synthèse du carbonate d’ammonium
Différentes méthodes peuvent synthétiser le (NH4)2CO3, en fonction des matériaux avec lesquels elles commencent et de la pureté souhaitée du produit. Voici quelques exemples de méthodes de synthèse de (NH4)2CO3 :
- Une méthode consiste à faire réagir le sulfate d’ammonium avec du chlorure d’ammonium et du carbonate de calcium dans un four. La réaction produit du (NH4)2CO3 et du chlorure de calcium comme sous-produits. La réaction est :
(NH4)2SO4 + 2 NH4Cl + CaCO3 -> 2 (NH4)2CO3 + CaCl2
- Une autre méthode consiste à réagir avec du dioxyde de carbone et de l’ammoniac dans une solution aqueuse. La réaction produit du (NH4)2CO3 et de l’eau comme sous-produits. La réaction est :
CO2 + 2 NH3 + H2O -> (NH4)2CO3 + H2O
- Une troisième méthode consiste à exposer une solution d’ammonium à de l’air contenant du dioxyde de carbone. Le bicarbonate d’ammonium est le produit de la réaction et le chauffage peut le décomposer davantage en (NH4)2CO3.
Les réactions sont :
NH3 + CO2 + H2O -> NH4HCO3
NH4HCO3 -> NH3 + CO2 + H2O
(NH4)2CO3 -> (NH4)2CO3
- L’exposition du bicarbonate d’ammonium à l’air produit du (NH4)2CO3 pour un usage commercial. Le bicarbonate d’ammonium se décompose en ammoniac et en dioxyde de carbone, qui réagissent à nouveau pour former (NH4)2CO3. Le processus est :
NH4HCO3 -> NH3 + CO2
NH3 + CO2 -> (NH4)2CO3
Utilisations du carbonate d’ammonium
Le (NH4)2CO3 a diverses utilisations dans différents domaines, tels que :
- Les boulangers l’utilisent comme agent levant, notamment pour les biscuits et les crackers plats ou croustillants. Il produit du dioxyde de carbone et des gaz ammoniac qui aident la pâte à lever et créent une texture légère. Il rehausse également la saveur et l’arôme des produits de boulangerie.
- Les gens l’utilisent comme sel odorant pour réanimer les personnes qui se sont évanouies ou qui se sentent mal. Il stimule le système respiratoire et augmente la tension artérielle en libérant des vapeurs d’ammoniaque qui irritent le nez et les poumons.
- Certains sirops contre la toux et expectorants, comme le sirop contre la toux de Buckley, l’utilisent comme ingrédient actif. Il aide à relâcher et à expulser les mucosités de la poitrine et de la gorge en augmentant la sécrétion de mucus.
- Les médecins l’utilisent comme émétique pour provoquer des vomissements en cas d’empoisonnement ou de surdosage. Il irrite la muqueuse de l’estomac et provoque des nausées et des vomissements en libérant du dioxyde de carbone.
- Les chimistes l’utilisent comme réactif dans certaines réactions chimiques, telles que la synthèse de l’urée, du nitrate d’ammonium et du sulfate d’ammonium. Il agit également comme tampon pour maintenir le pH des solutions.
Des questions:
Q : Le carbonate d’ammonium est-il acide ou basique ?
R : (NH4)2CO3 est un sel qui peut réagir à la fois avec les acides et les bases. Lorsqu’il se dissout dans l’eau, il forme des ions ammonium et des ions carbonate. Les ions ammonium peuvent agir comme des acides faibles et donner des protons à l’eau, tandis que les ions carbonate peuvent agir comme des bases faibles et accepter les protons de l’eau. Le pH de la solution dépend des forces relatives des ions ammonium et des ions carbonate. Si les ions carbonate sont des bases plus fortes que les ions ammonium ne sont des acides, la solution sera basique. La solution sera acide si les ions ammonium sont des acides plus forts que les ions carbonate ne sont des bases. Si les ions ammonium et les ions carbonate ont des forces similaires, la solution sera neutre.
Q : Le carbonate d’ammonium est-il un sel ?
R : Oui, (NH4)2CO3 est un sel. Un sel est un composé qui se forme lorsqu’un acide et une base se neutralisent. Le (NH4)2CO3 peut se former lorsque l’ammoniac, une base faible, réagit avec l’acide carbonique, un acide faible. La réaction est :
2NH3 + H2CO3 -> (NH4)2CO3 + H2O
L’ammoniac et l’acide carbonique sont la base mère et l’acide du (NH4)2CO3.
Q : Le carbonate d’ammonium (aq) a-t-il une odeur sous forme aqueuse ?
R : Oui, (NH4)2CO3 (aq) a une odeur sous forme aqueuse. L’odeur est due à la libération d’ammoniac gazeux de la solution. Le gaz ammoniac a une odeur âcre qui peut irriter le nez et les poumons. L’ammoniac gazeux peut s’échapper de la solution car il est volatil et a une faible solubilité dans l’eau. La quantité d’ammoniac gazeux libérée dépend de la température et de la concentration de la solution.
Q : Quel type d’atome est le carbonate d’ammonium ?
R : (NH4)2CO3 n’est pas un atome, mais une molécule. Une molécule est un groupe d’atomes liés entre eux par le partage d’électrons. Un atome est la plus petite unité de matière possédant une identité chimique définie. Le (NH4)2CO3 est une molécule composée de quatre types d’atomes différents : l’azote, l’hydrogène, le carbone et l’oxygène. La formule moléculaire de (NH4)2CO3 est (NH4)2CO3.
Q : Combien de moles y a-t-il dans le carbonate d’ammonium ?
R : Pour répondre à cette question, nous devons savoir quelle quantité de (NH4)2CO3 nous avons en termes de masse ou de volume. Une taupe est une unité de mesure qui représente 6,022 x 10^23 particules d’une substance. Le nombre de moles d’une substance peut être calculé en divisant sa masse par sa masse molaire ou en multipliant son volume par sa molarité. La masse molaire de (NH4)2CO3 est 96,09 g/mol. La molarité du (NH4)2CO3 dépend de sa dissolution dans l’eau.
Par exemple, si nous avons 10 g de (NH4)2CO3, nous pouvons trouver le nombre de moles en divisant 10 g par 96,09 g/mol :
10 g / 96,09 g/mol = 0,104 mole
Si nous avons 100 ml de solution 0,1 M (NH4)2CO3, nous pouvons trouver le nombre de moles en multipliant 100 ml par 0,1 mol/L :
100 ml x 0,1 mole/L = 0,01 mole
Q : Quelle est la formule chimique du carbonate d’ammonium ?
R : La formule chimique du carbonate d’ammonium est (NH4)2CO3. Cette formule montre qu’une molécule de (NH4)2CO3 contient deux ions ammonium (NH4+) et un ion carbonate (CO3 2-). Les charges des ions s’équilibrent, donc la charge globale de la molécule est nulle.
Q : Combien de moles d’ions ammonium y a-t-il dans 6,995 g de carbonate d’ammonium ?
R : Pour répondre à cette question, nous devons suivre deux étapes :
- Tout d’abord, nous devons déterminer combien de moles de (NH4)2CO3 contiennent 6,995 g en divisant 6,995 g par sa masse molaire (96,09 g/mol) :
6,995 g / 96,09 g/mol = 0,0728 mole
- Deuxièmement, nous devons multiplier ce nombre par deux, car chaque mole de (NH4)2CO3 contient deux moles d’ions ammonium :
0,0728 mole x 2 = 0,1456 mole
Il y a donc 0,1456 mole d’ions ammonium dans 6,995 g de (NH4)2CO3.
Q : Quel est le gaz produit lorsque l’acide chlorhydrique réagit avec le carbonate d’ammonium ?
R : Lorsque l’acide chlorhydrique réagit avec le (NH4)2CO3, ils subissent une réaction de double déplacement pour produire du chlorure d’ammonium et de l’acide carbonique. L’acide carbonique se décompose ensuite en eau et en dioxyde de carbone. Le dioxyde de carbone est le gaz produit par cette réaction. L’équation globale de cette réaction est la suivante :
(NH4)2CO3 + 2 HCl -> 2 NH4Cl + H2CO3
H2CO3 -> H2O + CO2
L’équation ionique nette de cette réaction est :
CO3 2- + 2 H+ -> H2O + CO2
