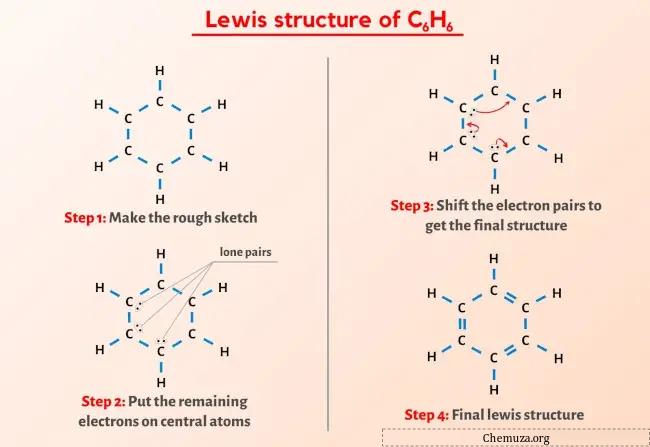
Vous avez donc déjà vu l’image ci-dessus, n’est-ce pas ?
Laissez-moi vous expliquer brièvement l’image ci-dessus.
La structure Lewis C6H6 (benzène) a 6 atomes de carbone (C) dans une structure en forme d’anneau et chaque atome de carbone est attaché à 1 atome d’hydrogène (H). Il existe des doubles liaisons alternées dans la structure cyclique du carbone (C).
Si vous n’avez rien compris de l’image ci-dessus de la structure Lewis de C6H6, alors restez avec moi et vous obtiendrez l’explication détaillée étape par étape sur le dessin d’une structure Lewis de C6H6 .
Passons donc aux étapes de dessin de la structure de Lewis de C6H6 (benzène).
Étapes du dessin de la structure Lewis C6H6
Étape 1 : Trouver le nombre total d’électrons de valence dans la molécule C6H6
Afin de trouver le nombre total d’électrons de valence dans une molécule C6H6, vous devez tout d’abord connaître les électrons de valence présents dans l’atome de carbone ainsi que dans l’atome d’hydrogène.
(Les électrons de valence sont les électrons présents sur l’ orbite la plus externe de tout atome.)
Ici, je vais vous expliquer comment trouver facilement les électrons de valence du carbone ainsi que de l’hydrogène à l’aide d’un tableau périodique.
Total des électrons de valence dans la molécule C6H6
→ Électrons de Valence donnés par l’atome de carbone :
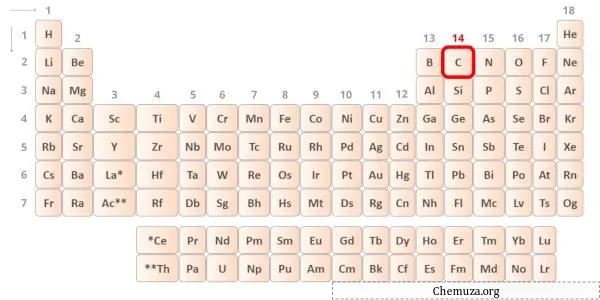
Le carbone est un élément du groupe 14 du tableau périodique. [1] Par conséquent, les électrons de valence présents dans le carbone sont 4 .
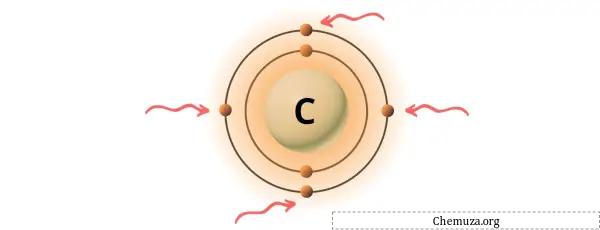
Vous pouvez voir les 4 électrons de valence présents dans l’atome de carbone, comme le montre l’image ci-dessus.
→ Électrons de Valence donnés par l’atome d’hydrogène :
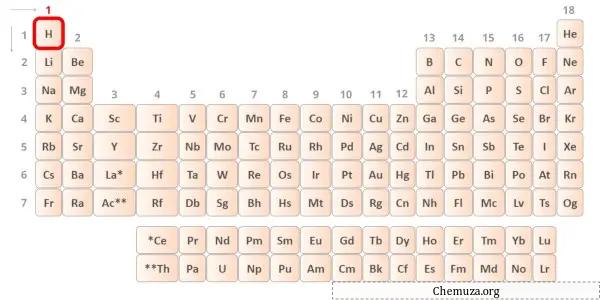
L’hydrogène est un élément du groupe 1 du tableau périodique. [2] Par conséquent, l’électron de valence présent dans l’hydrogène est 1 .

Vous pouvez voir qu’un seul électron de valence est présent dans l’atome d’hydrogène, comme le montre l’image ci-dessus.
Ainsi,
Total des électrons de valence dans la molécule C6H6 = électrons de valence donnés par 6 atomes de carbone + électrons de valence donnés par 6 atomes d’hydrogène = 4(6) + 1(6) = 30 .
Étape 2 : Préparez l’esquisse
La structure de Lewis du benzène (C6H6) comporte 6 atomes de carbone disposés en structure cyclique.
De plus, chacun de ces atomes de carbone est associé à 1 atome d’hydrogène.
Dessinons donc le croquis qui représente l’anneau de 6 atomes de carbone et d’atomes d’hydrogène attachés à chaque carbone.
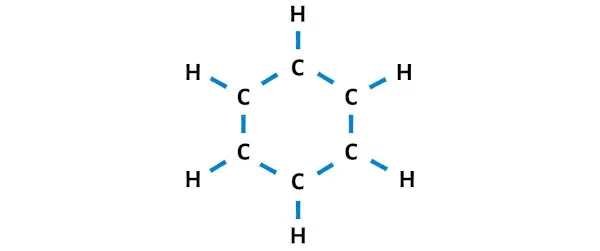
Il y a 12 liaisons simples dans le croquis ci-dessus. Ainsi, sur un total de 30 électrons de valence, 24 électrons de valence sont utilisés dans le schéma ci-dessus.
Étape 3 : Gardez les électrons restants sur l’atome central
Vous pouvez voir qu’à l’étape 1, nous avons calculé le nombre total d’électrons de valence présents dans la molécule C6H6.
La molécule C6H6 possède un total de 30 électrons de valence et parmi ceux-ci, seuls 24 électrons de valence sont utilisés dans le schéma ci-dessus.
Donc le nombre d’électrons restants = 30 – 24 = 6 .
Vous devez placer ces 6 électrons (c’est-à-dire 3 paires d’électrons ) sur les atomes de carbone dans le schéma ci-dessus de la molécule C6H6.
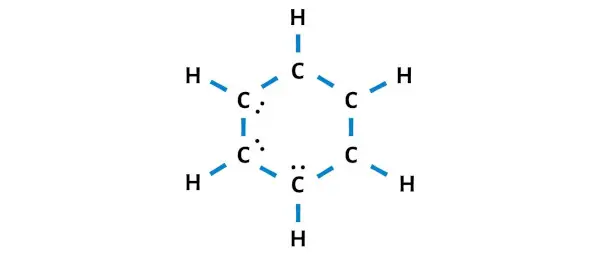
Passons maintenant à l’étape suivante.
Étape 4 : Rendre tous les atomes stables
À partir du croquis ci-dessus, vous pouvez voir que les atomes d’hydrogène externes forment un duplet . Ils sont donc stables.
Désormais, sur les 6 atomes de carbone, les trois atomes de carbone ne forment pas un octet .
Nous devons donc déplacer les paires d’électrons de telle manière que tout le carbone forme un octet et devienne stable.
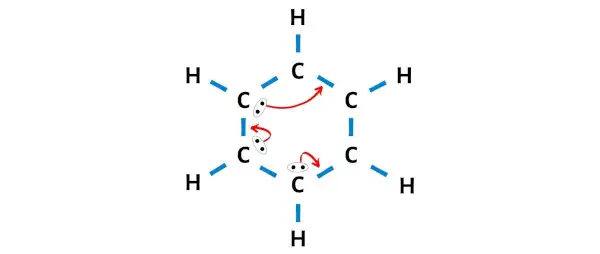
Après avoir déplacé les paires d’électrons, vous pouvez voir que les 6 atomes de carbone forment un octet et qu’ils sont désormais stables.
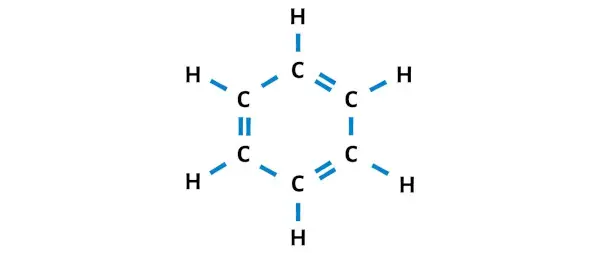
Il s’agit donc de la structure de Lewis stable du benzène (ou C6H6).
J’espère que vous avez complètement compris toutes les étapes ci-dessus.
Pour plus de pratique et une meilleure compréhension, vous pouvez essayer d’autres structures de Lewis répertoriées ci-dessous.
Essayez (ou au moins voyez) ces structures de Lewis pour une meilleure compréhension :
