Le benzène ou C6H6 est un liquide incolore et hautement inflammable avec une odeur sucrée. Il est utilisé dans la production de plastiques, de fibres synthétiques, de caoutchouc, de pesticides et d’autres produits chimiques. C’est un cancérigène connu et peut causer des problèmes de santé.
| Nom de l’UICPA | Benzène |
| Formule moléculaire | C6H6 |
| Numero CAS | 71-43-2 |
| Synonymes | Benzol, Phène, Annulène, Cyclohexatriène, etc. |
| InChI | InChI=1S/C6H6/c1-2-4-6-5-3-1/h1-6H |
Propriétés du benzène
Masse molaire du Benzène
Le benzène a une masse molaire de 78,11 g/mol. C’est un composé organique cyclique composé de six atomes de carbone et de six atomes d’hydrogène. La masse molaire du benzène est calculée en additionnant les masses atomiques de ses atomes constitutifs, qui sont de 12,01 g/mol pour le carbone et de 1,01 g/mol pour l’hydrogène. Le benzène est largement utilisé dans l’industrie chimique comme matière première pour la production de nombreux composés importants. La masse molaire du benzène est importante pour déterminer la quantité de composé nécessaire aux réactions et autres applications.
Formule de benzène
Le benzène a la formule chimique C6H6. Cette formule représente le nombre et le type d’atomes présents dans la molécule. La formule du benzène est importante pour déterminer ses propriétés physiques et chimiques, ainsi que sa réactivité dans les réactions chimiques. La formule du benzène est également utilisée pour nommer et identifier le composé dans divers contextes, comme dans la littérature chimique et les documents réglementaires.
Point d’ébullition du benzène
Le benzène a un point d’ébullition de 80,1°C ou 176,2°F. Ceci est relativement faible par rapport à d’autres composés organiques de poids moléculaire similaire. Le point d’ébullition de C6H6 est dû à ses forces d’attraction intermoléculaires, notamment les forces de Van der Waals. À mesure que la température augmente, l’énergie cinétique des molécules augmente également, conduisant finalement à la rupture de ces forces intermoléculaires et au passage de la phase liquide à la phase gazeuse. Le faible point d’ébullition du C6H6 le rend utile dans les applications où il est nécessaire d’éliminer le composé par évaporation.
Point de fusion du benzène
Le C6H6 a un point de fusion de 5,5°C ou 41,9°F. Ceci est relativement faible par rapport à d’autres composés aromatiques de poids moléculaire similaire. Le point de fusion du C6H6 est dû à sa structure moléculaire, qui consiste en un anneau plan d’atomes de carbone avec des doubles liaisons alternées. La disposition des électrons dans l’anneau confère à C6H6 sa stabilité caractéristique et le rend résistant à de nombreuses réactions chimiques. Le faible point de fusion du C6H6 le rend utile dans les applications où il est nécessaire de faire fondre le composé pour un traitement ultérieur.
Densité du benzène g/ml
Le benzène a une densité de 0,879 g/mL à température ambiante (25°C ou 77°F). La densité du benzène est une mesure de la masse par unité de volume du composé. La faible densité du benzène le rend utile dans les applications où un solvant de faible densité est requis, comme dans la séparation de composés en fonction de leur densité.
Poids moléculaire du benzène
Le benzène a un poids moléculaire de 78,11 g/mol. Le poids moléculaire du benzène est la somme des poids atomiques de ses atomes constitutifs. Le poids moléculaire du benzène est important pour déterminer la stœchiométrie des réactions et pour déterminer la concentration de benzène dans les solutions.
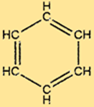
Structure du benzène
C6H6 possède une structure unique constituée d’un anneau hexagonal d’atomes de carbone, chacun étant lié à deux autres atomes de carbone et à un atome d’hydrogène. Les doubles liaisons alternées dans l’anneau confèrent à C6H6 sa stabilité caractéristique et le rendent résistant à de nombreuses réactions chimiques. La structure du C6H6 en fait également une matière première utile pour la production de nombreux composés importants.
| Apparence | Liquide incolore |
| Gravité spécifique | 0,879 g/ml |
| Couleur | Incolore |
| Odeur | Doux |
| Masse molaire | 78,11 g/mole |
| Densité | 0,879 g/ml |
| Point de fusion | 5,5°C (41,9°F) |
| Point d’ébullition | 80,1°C (176,2°F) |
| Point d’éclair | -11 °C (12,2 °F) |
| Solubilité dans l’eau | 1,79 g/L |
| Solubilité | Insoluble dans l’eau, soluble dans les solvants organiques |
| Pression de vapeur | 12,1 kPa à 20°C |
| Densité de vapeur | 2,8 (air=1) |
| pKa | 43.2 |
| pH | Neutre |
Sécurité et dangers du benzène
Le C6H6 est un composé hautement inflammable et toxique qui présente des risques importants pour la santé humaine et l’environnement. C’est un cancérigène connu et peut provoquer une leucémie, une anémie aplasique et d’autres troubles sanguins chez l’homme. L’exposition au C6H6 peut se produire par inhalation, contact cutané ou ingestion et peut entraîner des effets aigus et chroniques sur la santé. Il est important de manipuler le C6H6 en prenant les précautions de sécurité appropriées, notamment une ventilation adéquate, des vêtements de protection et une protection respiratoire. Le C6H6 doit également être stocké et éliminé conformément aux réglementations locales afin de minimiser la contamination de l’environnement et les risques pour la santé publique.
| Symboles de danger | Crâne et os croisés, Flamme |
| Description de la sécurité | Facilement inflammable, Toxique, Cancérogène, Nocif en cas d’ingestion, Irritant |
| Identifiants ONU | UN 1114 (Benzène), UN 1992 (Liquides inflammables, toxiques) |
| Code SH | 2902.20.00 |
| Classe de danger | 3 (Liquides inflammables), 6.1 (Substances toxiques), 8 (Substances corrosives) |
| Groupe d’emballage | II (Benzène), III (Liquides inflammables, toxiques) |
| Toxicité | Toxicité aiguë : Très toxique (DL50 : 2,5 g/kg par voie orale, 0,44 mg/L par inhalation), Toxicité chronique : Cancérogène, Mutagène, Toxicité pour la reproduction |
Méthodes de synthèse du benzène
Il existe plusieurs méthodes pour synthétiser le benzène, un produit chimique industriel important utilisé dans la production de plastiques, de caoutchouc et de produits pharmaceutiques.
Une méthode courante est le reformage catalytique du naphta de pétrole, qui consiste à chauffer le naphta à des températures élevées en présence d’un catalyseur, tel que le platine ou le rhénium, pour produire un mélange d’hydrocarbures aromatiques, dont le benzène.
Une autre méthode est l’hydrodésalkylation du toluène, qui consiste à faire réagir le toluène avec de l’hydrogène en présence d’un catalyseur, tel que l’oxyde de chrome ou l’oxyde de molybdène, pour éliminer le groupe méthyle et former du benzène.
La pyrolyse d’hydrocarbures, tels que le charbon ou le pétrole, à haute température en l’absence d’oxygène synthétise le benzène. Ce processus aboutit à la formation d’un mélange d’hydrocarbures aromatiques, dont le benzène.
D’autres méthodes de synthèse du benzène comprennent la réaction de l’acétylène avec lui-même en présence d’un catalyseur, tel que le cuivre, pour former du benzène, ainsi que la réaction du phénol avec le formaldéhyde en présence d’un catalyseur acide, tel que l’acide sulfurique, pour former du benzène. produire du benzène.
Chacune de ces méthodes présente ses propres avantages et inconvénients, en fonction de facteurs tels que le coût, l’efficacité et l’impact environnemental. Le choix de la méthode de synthèse du benzène dépendra de l’application spécifique et des exigences du processus de production.
Utilisations du benzène
Le benzène est un produit chimique industriel polyvalent et important avec un large éventail d’applications dans diverses industries. Certaines des principales utilisations du benzène sont :
- Production de plastiques : utilisé dans la production de divers types de plastiques, notamment le polystyrène, le polyuréthane et le nylon.
- Production de caoutchouc : Les producteurs de caoutchouc synthétique l’utilisent dans leur production. Les fabricants utilisent ensuite ce caoutchouc synthétique pour créer des pneus, des tuyaux, des courroies et d’autres produits en caoutchouc.
- Production de produits pharmaceutiques : utilisé comme matière première pour la production de divers produits pharmaceutiques, notamment des antibiotiques, des antihistaminiques et des analgésiques.
- Solvant : utilisé comme solvant pour une large gamme de composés organiques, notamment les graisses, les huiles, les résines et les cires.
- Carburant : Utilisé comme additif pour carburant à indice d’octane élevé, améliorant les performances des moteurs à essence.
- Extraction d’huiles : utilisée dans l’extraction d’huiles, telles que les huiles végétales et les huiles essentielles, à partir de plantes.
- Adhésifs : utilisés dans la production d’adhésifs, tels que la colle de caoutchouc et la colle de contact.
- Colorants : Utilisés dans la production de divers types de colorants, y compris les colorants synthétiques utilisés dans l’industrie textile.
Des questions:
Q : Le benzène est-il polaire ?
R : Non, le benzène est une molécule non polaire car elle a une structure symétrique et les polarités des liaisons individuelles s’annulent.
Q : À quoi sert le benzène ?
R : Le benzène est utilisé dans la production de divers matériaux, notamment les plastiques, le caoutchouc, les produits pharmaceutiques, les solvants, les additifs pour carburants, les adhésifs et les colorants.
Q : Quel composé conduira l’électricité lorsqu’il est dissous dans l’eau ? CH4, CuSO4, C6H6 ou C6H12O6 ?
R : Le CuSO4 conduit l’électricité lorsqu’il est dissous dans l’eau, car il se dissocie en ions, permettant ainsi la circulation du courant électrique.
Q : Le C6H6 est-il polaire ou non polaire ?
R : C6H6, également connu sous le nom de benzène, est une molécule non polaire car elle a une structure symétrique et les polarités des liaisons individuelles s’annulent.
Q : Le C6H6 est-il soluble dans l’eau ?
R : Non, le C6H6 n’est pas soluble dans l’eau car c’est une molécule non polaire et n’interagit pas bien avec les solvants polaires comme l’eau.
