Le nitrobenzène ou C6H5NO2 est un composé organique de couleur jaune pâle et d’odeur distincte. Il est utilisé comme précurseur pour la production d’aniline et d’autres produits chimiques. C’est aussi une substance toxique.
| Nom UICPA | Nitrobenzène |
| Formule moléculaire | C6H5NO2 |
| Numero CAS | 98-95-3 |
| Synonymes | Nitrobenzol, Nitrobenzeen, Essence de Mirbane, NB |
| InChI | InChI=1S/C6H5NO2/c8-7(9)6-4-2-1-3-5-6/h1-5H |
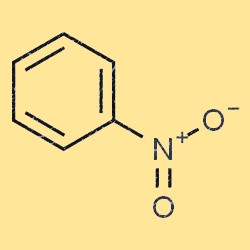
Structure du nitrobenzène
Le nitrobenzène a une structure moléculaire plate et planaire. Il se compose d’un cycle benzénique (C6H5) avec un groupe nitro (-NO2) attaché à l’un des atomes de carbone. Le groupe nitro est un groupe attracteur d’électrons, ce qui signifie qu’il réduit la densité électronique du cycle benzénique. Cette propriété rend le nitrobenzène moins réactif que le benzène dans de nombreuses réactions chimiques.
Formule nitrobenzène
La formule chimique du nitrobenzène est C6H5NO2. Cette formule représente le nombre et le type d’atomes qui composent la molécule. Le cycle benzénique constitue le squelette de la molécule, tandis que le groupe nitro constitue un groupe fonctionnel polaire qui influence les propriétés du composé. La formule du nitrobenzène est importante pour comprendre ses propriétés chimiques et physiques ainsi que sa réactivité avec d’autres substances.
Masse molaire du nitrobenzène
La masse molaire du nitrobenzène, également appelé C6H5NO2, est de 123,11 g/mol. Ceci est calculé en additionnant les masses atomiques de tous les atomes du composé. Le nitrobenzène a une masse molaire relativement élevée, due à la présence de six atomes de carbone et d’un atome d’azote dans sa structure chimique.
Point d’ébullition du nitrobenzène
Le nitrobenzène a un point d’ébullition de 210,9 °C. Ceci est relativement élevé par rapport à d’autres composés organiques ayant des poids moléculaires similaires. Le point d’ébullition élevé est dû à la présence de fortes forces d’attraction intermoléculaires entre les molécules de nitrobenzène, telles que les liaisons hydrogène et les interactions dipôle-dipôle.
Point de fusion du nitrobenzène
Le point de fusion du nitrobenzène est de 5,85 °C. Celui-ci est relativement faible par rapport à son point d’ébullition, ce qui peut s’expliquer par le fait que les forces d’attraction intermoléculaires à l’état solide sont plus faibles qu’à l’état liquide. De plus, le nitrobenzène peut présenter un polymorphisme, ce qui signifie qu’il peut exister dans plusieurs structures cristallines avec des points de fusion différents.
Densité du nitrobenzène g/ml
La densité du nitrobenzène est de 1,20 g/mL à température ambiante (25 °C). Cela signifie que le nitrobenzène est plus dense que l’eau, qui a une densité de 1 g/mL à la même température. La densité du nitrobenzène est influencée par son poids moléculaire ainsi que par la taille et la forme de ses molécules.
Poids moléculaire du nitrobenzène
Le poids moléculaire du nitrobenzène est de 123,11 g/mol. Ceci est calculé en additionnant les masses atomiques de tous les atomes du composé. Le poids moléculaire du nitrobenzène est important pour déterminer ses propriétés physiques et chimiques, telles que le point d’ébullition, le point de fusion et la solubilité.
| Apparence | Liquide jaune pâle |
| Gravité spécifique | 1,20 g/cm3 |
| Couleur | Jaune pâle |
| Odeur | Caractéristique |
| Masse molaire | 123,11 g/mole |
| Densité | 1,20 g/mL à 25 °C |
| Point de fusion | 5,85 °C |
| Point d’ébullition | 210,9 °C |
| Point d’éclair | 77 °C |
| Solubilité dans l’eau | 7,9 g/L à 25 °C |
| Solubilité | Soluble dans les solvants organiques |
| Pression de vapeur | 0,68 mmHg à 25 °C |
| Densité de vapeur | 4,35 (air=1) |
| pKa | -1,15 |
| pH | 7 (neutre) |
Sécurité et dangers du nitrobenzène
Le nitrobenzène est une substance hautement toxique qui présente plusieurs risques pour la sécurité et la santé. Il peut provoquer une irritation de la peau, des yeux et des voies respiratoires par contact ou par inhalation. Une exposition prolongée au nitrobenzène peut provoquer des lésions hépatiques et rénales, une anémie et une méthémoglobinémie. Le nitrobenzène est également très inflammable et peut s’enflammer à des températures relativement basses. De plus, il peut dégager des fumées toxiques lorsqu’il est chauffé, brûlé ou décomposé. Il est donc essentiel de manipuler le nitrobenzène avec précaution, de porter un équipement de protection approprié et de le stocker dans un endroit frais et sec, à l’écart des sources d’inflammation et des substances incompatibles.
| Symboles de danger | T, N |
| Description de la sécurité | Très toxique, nocif en cas d’ingestion, d’inhalation ou d’absorption cutanée, provoque de graves brûlures cutanées et des lésions oculaires. |
| Identifiants ONU | UN1662 |
| Code SH | 2904.90.90 |
| Classe de danger | 6.1 |
| Groupe d’emballage | II |
| Toxicité | Très toxique |
Méthodes de synthèse du nitrobenzène
Le nitrobenzène peut être synthétisé par plusieurs méthodes, notamment la nitration du benzène, la réduction du nitrobenzène et l’hydrogénation du nitrobenzène. La méthode la plus couramment utilisée est la nitration du benzène, qui implique la réaction du benzène avec un mélange d’acide nitrique et d’acide sulfurique à une température d’environ 50°C. La réaction de nitration produit un mélange de nitrobenzène, ainsi que d’autres dérivés nitro du benzène.
Une autre méthode de synthèse du nitrobenzène est la réduction du nitrobenzène, qui implique l’utilisation d’agents réducteurs tels que le fer ou le zinc et l’acide chlorhydrique. La réaction de réduction convertit le groupe nitro (-NO2) du nitrobenzène en un groupe amino (-NH2), produisant de l’aniline comme sous-produit.
L’hydrogénation du nitrobenzène est une autre méthode de synthèse de l’aniline. Cette méthode implique l’utilisation d’un catalyseur, tel que le nickel ou le palladium, et d’hydrogène gazeux, qui réagit avec le nitrobenzène pour produire de l’aniline.
Utilisations du nitrobenzène
Le nitrobenzène est un produit chimique polyvalent utilisé dans un large éventail d’applications.
- L’industrie chimique utilise le nitrobenzène comme précurseur de l’aniline, un ingrédient important dans la production de colorants, de caoutchouc et de produits pharmaceutiques. Le nitrobenzène est une matière première précieuse pour la fabrication d’autres produits chimiques comme le phénol, utilisé dans la production de plastiques, de résines et d’adhésifs.
- Les composés organiques tels que les huiles, les graisses et les cires peuvent être dissous à l’aide du nitrobenzène, ce qui en fait un solvant utile. Dans l’industrie alimentaire, le nitrobenzène est utilisé comme agent aromatisant, principalement dans la production de chewing-gum.
- Le C6H5NO2 est un composant essentiel dans la production d’explosifs comme le TNT (trinitrotoluène). En tant qu’additif pour carburant, le nitrobenzène contribue à augmenter l’indice d’octane de l’essence.
- Le C6H5NO2 entre également dans la fabrication de divers pesticides et herbicides, notamment des insecticides et des fongicides.
- La production de fibres synthétiques comme le nylon repose également sur le nitrobenzène comme composant essentiel.
Dans l’ensemble, la nature polyvalente du nitrobenzène en fait un produit chimique essentiel dans de nombreuses industries, notamment les industries chimique, alimentaire et textile. Cependant, une manipulation appropriée et des précautions de sécurité sont nécessaires lors de l’utilisation du nitrobenzène en raison de sa toxicité et de son inflammabilité.
Des questions:
Réaction du nitrobenzène à l’aniline
La conversion du nitrobenzène en aniline est une réaction en deux étapes qui implique la réduction du groupe nitro (-NO2) en un groupe amino (-NH2) et l’hydrolyse ultérieure du produit intermédiaire.
La réduction de C6H5NO2 est généralement réalisée à l’aide d’un agent réducteur, tel que le fer ou le zinc, et d’une solution acide, telle que l’acide chlorhydrique. La réaction produit un produit intermédiaire, le nitrosobenzène, qui est ensuite réduit en aniline en présence d’un catalyseur acide ou basique.
L’hydrolyse du nitrosobenzène intermédiaire en aniline est réalisée en traitant l’intermédiaire avec une solution acide, telle que de l’acide chlorhydrique dilué. La réaction produit de l’aniline, ainsi que de l’eau et de l’oxyde d’azote (NO).
La réaction globale peut être représentée comme suit : Nitrobenzène + 3 H2 → Aniline + 2 H2O + N2
