Le 1-bromobutane est un composé organique liquide incolore de formule moléculaire C4H9Br. Il est utilisé comme agent alkylant en synthèse organique et comme solvant dans l’industrie.
| Nom UICPA | Bromure de butyle |
| Formule moléculaire | C4H9Br |
| Numero CAS | 109-65-9 |
| Synonymes | 1-bromobutane, bromure de n-butyle, bromure de butyle, bromobutane, butane, 1-bromo-, 109-65-9, 1-brombutan, 1-bromobutane, n-C4H9Br |
| InChI | InChI=1S/C4H9Br/c1-2-3-4-5/h2-4H2,1H3 |
1-Bromobutane masse molaire
La masse molaire du 1-Bromobutane est 137,03 g/mol. Pour obtenir la masse molaire du 1-Bromobutane, on additionne les masses atomiques de carbone, d’hydrogène et de brome dans une seule molécule. Les calculs chimiques nécessitent souvent la conversion de la masse d’une substance en son nombre de moles, et la masse molaire est essentielle pour cette conversion.
Densité du 1-Bromobutane g/ml
La densité du 1-bromobutane est de 1,27 g/mL à 25 °C (77 °F). Il s’agit de la masse par unité de volume de la substance. La densité du 1-Bromobutane est supérieure à celle de l’eau, ce qui lui permet d’être facilement séparé des solutions aqueuses.
Point d’ébullition du 1-bromobutane
Le point d’ébullition du 1-bromobutane est de 101 °C (214 °F). C’est la température à laquelle la pression de vapeur du liquide est égale à la pression externe. C’est une mesure de la force des forces intermoléculaires dans le liquide. Le point d’ébullition du 1-bromobutane en fait un solvant et un réactif utile en chimie organique.
Point de fusion du C4H9Br
Le point de fusion du C4H9Br est de -112 °C (-170 °F). C’est la température à laquelle les phases solide et liquide de la substance sont en équilibre. Le point de fusion dépend de la force des forces intermoléculaires présentes dans le solide. Le faible point de fusion du C4H9Br en fait un liquide à température ambiante et permet de le manipuler facilement.
Poids moléculaire C4H9Br
Le poids moléculaire du C4H9Br est de 137,03 g/mol. C’est la somme des poids atomiques de tous les atomes de la molécule. Le poids moléculaire est utilisé pour calculer la quantité d’une substance nécessaire à une réaction ou pour déterminer la quantité de produit obtenu.
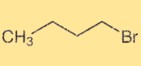
Structure 1-bromobutane
Le 1-bromobutane a une structure alkyle à chaîne droite avec un atome de brome attaché au quatrième atome de carbone. C’est un composé organique de formule chimique C4H9Br. La structure du 1-Bromobutane détermine ses propriétés physiques et chimiques et sa réactivité dans les réactions organiques.
Formule 1-Bromobutane
La formule du 1-bromobutane est C4H9Br. Cela montre le nombre et le type d’atomes présents dans la molécule. La formule du 1-bromobutane est importante pour déterminer sa réactivité et son comportement dans les réactions chimiques.
| Apparence | Liquide incolore |
| Gravité spécifique | 1,27 à 25°C |
| Couleur | Incolore |
| Odeur | Odeur caractéristique et douce |
| Masse molaire | 137,03 g/mole |
| Densité | 1,27 g/mL à 25°C |
| Point de fusion | -112°C |
| Point d’ébullition | 101°C |
| Point d’éclair | 25°C |
| Solubilité dans l’eau | Légèrement soluble |
| Solubilité | Soluble dans l’éthanol, l’éther, le chloroforme |
| La pression de vapeur | 10 mmHg à 25°C |
| Densité de vapeur | 4.6 |
| pKa | 16,5 |
| pH | Neutre |
1-Bromobutane Sécurité et dangers
Le 1-bromobutane est un produit chimique dangereux qui doit être manipulé avec prudence. Il est toxique s’il est ingéré ou inhalé et peut provoquer une irritation de la peau et des yeux au contact. Le produit chimique est également inflammable et peut présenter un risque d’incendie s’il est exposé à la chaleur, aux étincelles ou aux flammes. Il est important de porter un équipement de protection approprié tel que des gants, des lunettes et une blouse de laboratoire lors de la manipulation du 1-Bromobutane. Le produit chimique doit être stocké dans un endroit frais, sec et bien ventilé et tenu à l’écart des sources d’inflammation. En cas d’exposition accidentelle, rincez immédiatement la zone affectée avec de l’eau et consultez un médecin.
| Symboles de danger | T, F |
| Description de la sécurité | Tenir à l’écart de la chaleur, des étincelles et des flammes. Porter des gants de protection/un équipement de protection des yeux/du visage. EN CAS D’INHALATION : Amener la victime à l’air frais et la maintenir au repos dans une position confortable pour respirer. EN CAS D’INGESTION : Appelez un CENTRE ANTIPOISON ou un médecin si vous ne vous sentez pas bien. Rincer la bouche. Conserver dans un endroit bien ventilé. Garder son calme. Éliminer le contenu/récipient conformément aux réglementations locales/régionales/nationales/internationales. |
| Identifiants ONU | UN1126 |
| Code SH | 290339 |
| Classe de danger | 3 |
| Groupe d’emballage | II |
| Toxicité | Toxique en cas d’ingestion ou d’inhalation. Peut provoquer une irritation de la peau et des yeux. |
Méthodes de synthèse du 1-bromobutane
Le C4H9Br peut être synthétisé par la réaction du 1-butanol et de l’acide bromhydrique (HBr) en présence d’acide sulfurique (H2SO4) comme catalyseur. C’est ce qu’on appelle la réaction d’halogénation catalysée par un acide. La réaction se déroule comme suit :
- HBr est ajouté au 1-butanol en présence d’acide sulfurique.
- Le HBr protone le groupe hydroxyle du 1-butanol, créant un bon groupe partant (eau).
- Le groupe partant (eau) est remplacé par l’ion bromure (Br-) du HBr, formant C4H9Br.
- Le mélange réactionnel est ensuite chauffé pour distiller le C4H9Br.
Une autre méthode de synthèse du C4H9Br consiste à faire réagir le butène avec du bromure d’hydrogène en présence d’un initiateur peroxyde tel que le peroxyde de benzoyle ou le peroxyde de t-butyle. C’est ce qu’on appelle la réaction d’halogénation radicalaire. La réaction se déroule comme suit :
- Le butène est ajouté à un mélange de bromure d’hydrogène et d’un initiateur peroxyde.
- L’initiateur peroxyde subit un clivage homolytique, produisant deux radicaux réactifs.
- Les radicaux attaquent la double liaison du butène, formant un radical bromure et un radical centré sur le carbone.
- Le radical bromure réagit ensuite avec le radical centré sur le carbone, formant C4H9Br.
Ces deux méthodes sont largement utilisées pour la synthèse du C4H9Br et peuvent être optimisées pour produire des rendements élevés du produit. Cependant, il est important de suivre les précautions de sécurité appropriées lorsque vous travaillez avec des produits chimiques dangereux tels que le HBr et les peroxydes.
Utilisations du 1-bromobutane
Le C4H9Br est un produit chimique polyvalent utilisé dans diverses applications industrielles et de laboratoire.
- Les chimistes organiques utilisent le C4H9Br comme matière première pour synthétiser d’autres composés organiques, notamment pour la production de produits pharmaceutiques et agrochimiques.
- Les réactions chimiques nécessitent le C4H9Br comme solvant et agit comme réactif dans la synthèse organique.
- Les fabricants incorporent le C4H9Br dans les arômes, parfums et autres composés aromatiques. De plus, c’est un composant de la production de tensioactifs, largement utilisé dans les agents de nettoyage tels que les détergents et les savons.
- Le C4H9Br fonctionne comme un booster d’octane dans les additifs pour essence et est utilisé dans la production de réfrigérants et de polymères.
- Les techniques analytiques telles que la chromatographie en phase gazeuse nécessitent le C4H9Br comme matériau de référence standard en laboratoire. Les laboratoires d’enseignement et de recherche en chimie organique l’utilisent comme matière première pour diverses expériences.
Dans l’ensemble, les propriétés polyvalentes du C4H9Br en font un produit chimique important dans les domaines de la chimie, de la pharmacie et de l’industrie, avec une large gamme d’applications dans la synthèse organique, la fabrication et la recherche.
Des questions:
Votre tâche consiste à convertir le 2-bromobutane en 1-butène avec le rendement le plus élevé. Quels réactifs utiliseriez-vous ?
Pour convertir le 2-bromobutane en 1-butène avec le rendement le plus élevé, j’utiliserais une base forte telle que l’éthoxyde de sodium (NaOEt) dans l’éthanol comme réactif. La réaction se déroulerait comme une réaction d’élimination connue sous le nom de réaction de déshydrohalogénation.
La réaction se déroulerait comme suit :
- Le 2-bromobutane est ajouté à une solution d’éthoxyde de sodium dans l’éthanol.
- La base forte extrait un proton du carbone bêta adjacent au brome, formant un ion alcoxyde intermédiaire.
- L’ion intermédiaire alcoxyde subit l’élimination du groupe partant (brome), entraînant la formation de l’alcène (1-butène) et du bromure de sodium.
- Le mélange réactionnel est ensuite distillé pour éliminer le produit 1-butène.
En utilisant une base forte telle que NaOEt, la réaction peut être conduite vers la formation de 1-butène, et en utilisant de l’éthanol comme solvant, la réaction peut être réalisée de manière relativement sûre et rentable. De plus, l’utilisation d’une base forte et d’éthanol comme solvant peut conduire à des rendements élevés en 1-butène.
Pourquoi commencer par le 1-bromobutane pour votre nai dans le test de l’acétone ?
Commencer par C4H9Br pour le NAI dans le test à l’acétone est un moyen utile de déterminer si un composé organique donné contient ou non un atome d’halogène. Le test implique l’ajout d’iodure de sodium (NaI) au composé organique dissous dans l’acétone, suivi de l’ajout d’une petite quantité de chlore ou d’iode.
La réaction se déroule selon le mécanisme suivant :
- NaI est ajouté au composé organique dissous dans l’acétone, conduisant à la formation du sel halogénure de sodium et de l’halogénure organique correspondant.
- L’ajout d’une petite quantité de chlore ou d’iode conduit à la formation d’une petite quantité de gaz halogène, qui réagit avec l’halogénure de sodium pour former le gaz halogène correspondant.
- Le gaz halogène réagit ensuite avec l’halogénure organique pour former un précipité coloré, indiquant la présence de l’halogène dans le composé organique d’origine.
C4H9Br est un composé couramment utilisé pour ce test car il s’agit d’un composé organique simple et facilement accessible qui contient un atome d’halogène (brome). Il réagit également facilement avec l’iodure de sodium et le gaz halogène pour former un précipité coloré, ce qui en fait un composé de test utile pour détecter la présence d’un halogène dans d’autres composés organiques.
