L’éthanol ou C2H6O est un alcool incolore et inflammable dérivé de matières végétales, souvent utilisé comme biocarburant ou solvant. C’est également un ingrédient courant dans les boissons alcoolisées.
| Nom UICPA | Éthanol |
| Formule moléculaire | C2H6O |
| Numero CAS | 64-17-5 |
| Synonymes | Alcool éthylique, alcool de grain, EtOH, alcool |
| InChI | InChI=1S/C2H6O/c1-2-3/h3H,2H2,1H3 |
Propriétés de l’éthanol
Structure de Lewis C2H6O
La structure de Lewis pour C2H6O (également connu sous le nom d’éthanol) peut être dessinée comme suit :
HH
| |
HCCOH
| |
HH
Dans cette structure, les deux atomes de carbone sont liés l’un à l’autre par une seule liaison covalente. Chaque atome de carbone est également lié à trois atomes d’hydrogène et un atome de carbone est lié à un atome d’oxygène. L’atome d’oxygène est lié à l’atome de carbone par une simple liaison covalente et possède deux paires d’électrons libres.
Cette structure satisfait à la règle de l’octet, qui stipule que chaque atome de la molécule doit avoir huit électrons dans sa couche de valence. Les atomes de carbone ont quatre électrons dans leur couche de valence, tandis que les atomes d’hydrogène ont chacun un électron. L’atome d’oxygène possède six électrons de valence et, avec deux paires libres supplémentaires, il satisfait à la règle de l’octet.
C2H6O Masse molaire
L’éthanol a une masse molaire d’environ 46,07 g/mol. La masse molaire d’une substance est définie comme la masse d’une mole de cette substance. Dans le cas de l’éthanol, une mole d’éthanol contient environ 46,07 grammes de substance. La masse molaire est un paramètre utile dans les calculs chimiques car elle permet la conversion entre la masse et les moles d’une substance.
Point d’ébullition de l’éthanol
L’éthanol a un point d’ébullition d’environ 78,5 °C (173,3 °F) à pression standard. Ce point d’ébullition relativement bas facilite l’évaporation de l’éthanol, ce qui est utile dans de nombreux processus industriels. Par exemple, l’éthanol est couramment utilisé comme solvant dans la production de produits pharmaceutiques, de parfums et d’autres produits chimiques.
Point de fusion de l’éthanol
L’éthanol a un point de fusion d’environ -114,1 °C (-173,4 °F). Ce faible point de fusion fait de l’éthanol un liquide à température ambiante, c’est pourquoi il est couramment utilisé sous forme liquide comme solvant ou carburant. Le point de fusion de l’éthanol est inférieur à celui de l’eau, ce qui permet d’utiliser l’éthanol comme antigel dans les systèmes de refroidissement des automobiles.
Densité d’éthanol g/mL
La densité de l’éthanol est d’environ 0,789 g/mL à température et pression standard. Cela signifie qu’un millilitre d’éthanol pèse 0,789 gramme. La densité de l’éthanol est inférieure à celle de l’eau, qui a une densité de 1 g/mL à température et pression standard. Cela signifie que l’éthanol flottera à la surface de l’eau.
Éthanol Poids moléculaire
Le poids moléculaire de l’éthanol est d’environ 46,07 g/mol. Le poids moléculaire est la somme des poids atomiques de tous les atomes d’une molécule. Dans le cas de l’éthanol, il contient deux atomes de carbone, six atomes d’hydrogène et un atome d’oxygène. Le poids moléculaire est utilisé pour calculer le nombre de moles d’une substance dans une masse donnée de la substance.
Structure de l’éthanol
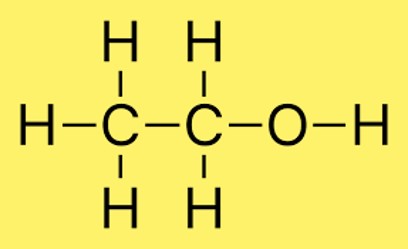
Dans la structure de l’éthanol, deux atomes de carbone se lient par une simple liaison et trois atomes d’hydrogène se lient à chaque atome de carbone. De plus, un atome d’hydrogène est lié à l’atome d’oxygène. La disposition des atomes dans la molécule est communément représentée par CH3CH2OH.
Formule à l’éthanol
La formule chimique de l’éthanol est C2H6O. Cette formule montre le nombre et le type d’atomes dans la molécule. La formule peut être utilisée pour calculer le poids moléculaire de l’éthanol, ainsi que le nombre de moles d’éthanol dans une masse donnée de la substance. La formule est également utile pour prédire le comportement chimique de l’éthanol lors de réactions avec d’autres produits chimiques.
| Apparence | Liquide incolore |
| Gravité spécifique | 0,789 |
| Couleur | Incolore |
| Odeur | Odeur caractéristique |
| Masse molaire | 46,07 g/mole |
| Densité | 0,789 g/ml |
| Point de fusion | -114,1 °C (-173,4 °F) |
| Point d’ébullition | 78,5 °C (173,3 °F) à pression standard |
| Point d’éclair | 13 °C (55 °F) |
| Solubilité dans l’eau | Miscible |
| Solubilité | Soluble dans les solvants polaires et non polaires |
| Pression de vapeur | 44,6 kPa à 20 °C |
| Densité de vapeur | 1,59 (air = 1) |
| pKa | 15,9 à 25 °C |
| pH | 7 (neutre) |
Sécurité et dangers liés à l’éthanol
L’éthanol est un liquide inflammable et peut présenter des risques d’incendie et d’explosion s’il n’est pas manipulé correctement. Les vapeurs d’éthanol peuvent également s’enflammer facilement et présenter un risque d’incendie sérieux. L’éthanol peut également être nocif s’il est ingéré, et une consommation excessive peut entraîner une intoxication alcoolique. L’inhalation de grandes quantités de vapeurs d’éthanol peut provoquer des étourdissements, des maux de tête et des nausées. Une exposition prolongée à l’éthanol peut également provoquer une irritation et un dessèchement de la peau. L’éthanol doit être stocké dans un endroit frais et bien ventilé, loin des sources d’inflammation et des substances incompatibles. Un équipement de protection approprié, tel que des gants et des lunettes de sécurité, doit être utilisé lors de la manipulation de l’éthanol.
| Symboles de danger | F, Xi, Flam. Liq. 2 |
| Description de la sécurité | Tenir à l’écart de la chaleur, des étincelles, des flammes nues et des surfaces chaudes. Interdiction de fumer. Utilisez des équipements électriques, de ventilation et d’éclairage antidéflagrants. Évitez de respirer les vapeurs. Porter des gants de protection, des lunettes de protection. En cas d’incendie : Utiliser de la poudre chimique sèche, du CO2, de l’eau pulvérisée ou de la mousse pour l’extinction. Éliminer le contenu/récipient conformément aux réglementations locales/régionales/nationales/internationales. |
| Identifiants ONU | UN1170 |
| Code SH | 2207.10.00 |
| Classe de danger | 3 |
| Groupe d’emballage | II |
| Toxicité | L’éthanol peut être toxique s’il est ingéré ou inhalé en grande quantité. Une exposition prolongée peut également provoquer une irritation et un dessèchement de la peau. Une ingestion chronique peut conduire à l’alcoolisme et à d’autres problèmes de santé. |
Méthodes de synthèse de l’éthanol
L’éthanol peut être synthétisé par diverses méthodes, notamment la fermentation, l’hydratation directe de l’éthylène et la conversion de la biomasse.
La fermentation est la méthode la plus courante pour produire de l’éthanol et implique la conversion des sucres et autres glucides en éthanol par des micro-organismes tels que la levure. Ce processus est utilisé pour produire de l’éthanol à partir de cultures telles que le maïs, l’orge et la canne à sucre, ainsi qu’à partir de déchets tels que les déchets alimentaires et les résidus agricoles.
L’hydratation directe de l’éthylène est une autre méthode de production d’éthanol. Dans ce processus, l’éthylène réagit avec l’eau en présence d’un catalyseur tel que l’acide phosphorique pour former de l’éthanol. Cette méthode est couramment utilisée en milieu industriel et est plus efficace que la fermentation.
La conversion de la biomasse est une autre méthode de production d’éthanol et implique la conversion de matières végétales telles que les copeaux de bois, les herbes et les résidus agricoles en éthanol. Le processus consiste à décomposer la cellulose et l’hémicellulose contenues dans la matière végétale en sucres simples qui peuvent être fermentés en éthanol.
D’autres méthodes de production d’éthanol comprennent la conversion catalytique du dioxyde de carbone et la réduction électrochimique du dioxyde de carbone.
Chacune de ces méthodes a ses avantages et ses inconvénients, et le choix de la méthode dépend de facteurs tels que la disponibilité des matières premières, le coût et l’efficacité. La fermentation reste la méthode de production d’éthanol la plus largement utilisée en raison de sa rentabilité et de sa fiabilité.
Utilisations de l’éthanol
L’éthanol a un large éventail d’utilisations industrielles, commerciales et personnelles. Certaines de ses utilisations courantes incluent :
- L’éthanol augmente les niveaux d’octane et réduit les émissions lorsqu’il est utilisé comme additif pour l’essence.
- L’éthanol est un solvant polyvalent couramment utilisé dans la production de produits pharmaceutiques, cosmétiques et de soins personnels.
- Les boissons alcoolisées telles que la bière, le vin et les spiritueux contiennent de l’éthanol comme ingrédient actif.
- Les désinfectants pour les mains, les nettoyants pour surfaces et autres produits de nettoyage utilisent de l’éthanol comme désinfectant efficace.
- L’éthanol sert de solvant dans l’extraction d’huiles essentielles, d’arômes et d’autres composés naturels.
- Les producteurs utilisent l’éthanol comme matière première pour la production d’autres produits chimiques, tels que l’acide acétique et l’éthylène.
- Les produits de soins personnels tels que les parfums, les lotions et les produits de soins capillaires utilisent de l’éthanol comme conservateur et ingrédient de parfum.
- Les laboratoires chimiques utilisent couramment l’éthanol comme solvant et réactif.
- Les systèmes de refroidissement automobiles et autres peuvent utiliser de l’éthanol comme agent antigel.
Des questions:
Combien d’atomes composent une molécule d’éthanol (C2H6O) ?
Une molécule d’éthanol (C2H6O) est composée de 9 atomes : 2 atomes de carbone, 6 atomes d’hydrogène et 1 atome d’oxygène.
