Le butane (C₄H₁₀) est un gaz d’hydrocarbure hautement inflammable. Il est couramment utilisé comme combustible pour les briquets et les réchauds de camping en raison de ses propriétés de combustion efficaces et de sa portabilité.
| Nom UICPA | Butane |
| Formule moléculaire | C₄H₁₀ |
| Numero CAS | 106-97-8 |
| Synonymes | n-Butane, hydrure de butyle, méthyléthylméthane, diéthyle |
| InChI | InChI=1S/C4H10/c1-3-4-2/h3-4H2,1-2H3 |
Propriétés du butane
Formule butane
La formule du butane est C₄H₁₀, ce qui indique qu’il est constitué de quatre atomes de carbone et de dix atomes d’hydrogène. La formule fournit des informations précieuses sur la composition chimique du butane, permettant aux scientifiques d’étudier ses propriétés et son comportement.
Butane Masse molaire
La masse molaire de l’hydrure de butyle peut être calculée en additionnant les masses atomiques de ses éléments constitutifs. Pour l’hydrure de butyle (C₄H₁₀), la masse molaire est d’environ 58,12 grammes par mole. La masse molaire est un paramètre crucial dans divers calculs chimiques et joue un rôle important dans la détermination des propriétés physiques et chimiques de l’hydrure de butyle.
Point d’ébullition du butane
L’hydrure de butyle a un point d’ébullition relativement bas d’environ -1°C (30°F). Cela signifie qu’à cette température ou au-dessus, l’hydrure de butyle passe facilement d’une phase liquide à une phase gazeuse. Le faible point d’ébullition fait de l’hydrure de butyle un carburant idéal pour des applications telles que les briquets et les réchauds de camping portables.
Butane Point de fusion
Le point de fusion de l’hydrure de butyle est d’environ -138,4°C (-217,12°F). À cette température ou en dessous, l’hydrure de butyle solide subit un changement de phase et passe à l’état liquide. Cependant, dans des conditions atmosphériques normales, l’hydrure de butyle est couramment rencontré sous sa forme gazeuse.
Densité du butane g/mL
La densité de l’hydrure de butyle est d’environ 2,48 grammes par millilitre. Cela indique que l’hydrure de butyle est plus léger que l’eau, qui a une densité de 1 g/mL. La densité de l’hydrure de butyle est une propriété cruciale qui détermine son comportement lors du stockage ou du transport, ainsi que ses caractéristiques de combustion.
Butane Poids moléculaire
Le poids moléculaire de l’hydrure de butyle est d’environ 58,12 grammes par mole. Il représente la somme des poids atomiques de tous les atomes d’une seule molécule d’hydrure de butyle. Le poids moléculaire est un paramètre essentiel pour divers calculs scientifiques et permet de comprendre les propriétés et le comportement de l’hydrure de butyle.
Structure du butane
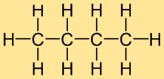
La structure de l’hydrure de butyle est constituée d’une chaîne droite de quatre atomes de carbone, auxquels sont liés dix atomes d’hydrogène. Les atomes de carbone sont disposés en une ligne continue et chaque atome de carbone forme des liaisons simples avec deux atomes de carbone voisins et trois atomes d’hydrogène. Cette structure linéaire contribue aux propriétés physiques et chimiques de l’hydrure de butyle.
Solubilité du butane
L’hydrure de butyle est considéré comme relativement insoluble dans l’eau. Il présente une faible solubilité en raison de sa nature non polaire et de ses faibles interactions intermoléculaires avec les molécules d’eau. Cependant, l’hydrure de butyle est hautement soluble dans les solvants organiques tels que l’éthanol et l’acétone. Ce comportement de solubilité est important dans diverses applications, telles que les processus d’extraction et les réactions à base de solvants.
| Apparence | Gaz incolore |
| Gravité spécifique | 2,48 |
| Couleur | N / A |
| Odeur | Inodore |
| Masse molaire | 58,12 g/mole |
| Densité | 2,48 g/ml |
| Point de fusion | -138,4°C (-217,12°F) |
| Point d’ébullition | -1°C (30°F) |
| Point d’éclair | -60°C (-76°F) |
| Solubilité dans l’eau | Insoluble |
| Solubilité | Soluble dans les solvants organiques |
| Pression de vapeur | 2,4 guichets automatiques à 20°C |
| Densité de vapeur | 2,07 (air = 1) |
| pKa | N / A |
| pH | N / A |
Sécurité et dangers du butane
L’hydrure de butyle présente certains risques pour la sécurité qui doivent être pris en compte. C’est un gaz hautement inflammable et peut facilement s’enflammer en présence d’une source d’inflammation. Des précautions doivent être prises pour éviter les incendies accidentels ou les explosions. Il est important de stocker et de manipuler l’hydrure de butyle dans des zones bien ventilées pour éviter l’accumulation de vapeurs inflammables. L’inhalation directe d’hydrure de butyle peut être nocive, car elle déplace l’oxygène et peut provoquer une asphyxie. De plus, l’exposition à des concentrations élevées d’hydrure de butyle peut provoquer des étourdissements, de la somnolence et des nausées. Il est essentiel de suivre les consignes de sécurité appropriées, telles que l’utilisation d’hydrure de butyle dans un équipement bien conçu et approuvé et l’évitement de tout contact avec des flammes nues ou des étincelles.
| Symboles de danger | Gaz inflammable |
| Description de la sécurité | Tenir à l’écart des flammes nues et des étincelles. Conserver dans un endroit bien ventilé. Évitez l’inhalation et le contact direct. |
| Identifiants des Nations Unies | ONU 1011 |
| Code SH | 2711.12.20 |
| Classe de danger | Classe 2.1 (Gaz inflammable) |
| Groupe d’emballage | Groupe d’emballage II |
| Toxicité | L’hydrure de butyle est généralement considéré comme ayant une faible toxicité. Cependant, l’inhalation de concentrations élevées peut provoquer des étourdissements, de la somnolence et des nausées. Il peut également déplacer l’oxygène dans les espaces clos, entraînant une asphyxie. Des procédures de ventilation et de manipulation appropriées doivent être suivies pour garantir la sécurité. |
Méthodes de synthèse du butane
Diverses méthodes synthétisent l’hydrure de butyle, impliquant principalement la production de pétrole ou de gaz naturel.
Distillation fractionnée : Au cours de la distillation fractionnée du pétrole brut ou du pétrole, le processus produit de l’hydrure de butyle comme sous-produit. Le processus de raffinage sépare les différentes fractions d’hydrocarbures en fonction de leur point d’ébullition, et l’hydrure de butyle est l’un des composants pouvant être isolés.
Traitement du gaz naturel : Le traitement du gaz naturel produit également de l’hydrure de butyle. Le gaz naturel contient divers hydrocarbures, notamment du méthane et des hydrocarbures supérieurs comme l’hydrure de butyle. Le mélange de gaz naturel subit des processus tels que l’absorption ou la séparation cryogénique pour séparer l’hydrure de butyle.
Craquage des hydrocarbures : le processus de craquage décompose les chaînes d’hydrocarbures les plus grandes en chaînes plus petites, produisant de l’hydrure de butyle. Cela implique de soumettre des hydrocarbures plus lourds à des températures élevées ou d’utiliser des catalyseurs pour générer de l’hydrure de butyle en tant que produit.
Isomérisation : l’isomérisation réorganise la structure moléculaire des hydrocarbures, permettant la synthèse de l’hydrure de butyle en isomérisant d’autres hydrocarbures comme le pentane ou l’hexane en ses isomères. Des catalyseurs spécifiques catalysent ce processus dans des conditions appropriées.
Processus de synthèse : En laboratoire, les scientifiques peuvent synthétiser l’hydrure de butyle par des voies de synthèse. Ils peuvent utiliser diverses réactions chimiques, telles que l’hydrogénation ou la réduction, pour produire de l’hydrure de butyle à partir de composés précurseurs.
Ces méthodes permettent de produire de l’hydrure de butyle dans des processus industriels à grande échelle ainsi que dans des laboratoires à plus petite échelle. Le choix de la méthode dépend de la disponibilité des matières premières, de la pureté souhaitée et des exigences spécifiques de l’application.
Utilisations du butane
L’hydrure de butyle trouve une application dans diverses industries et dans un usage quotidien en raison de ses propriétés bénéfiques. Voici quelques utilisations courantes de l’hydrure de butyle :
- Carburant : l’hydrure de butyle alimente les réchauds portables, les chauffages de camping et les briquets comme combustible, grâce à sa teneur élevée en énergie et à ses propriétés de combustion efficaces.
- Propulseur d’aérosol : l’hydrure de butyle propulse les produits en aérosol comme les laques pour cheveux, les assainisseurs d’air et les peintures en aérosol, leur permettant de se libérer sous forme de fine brume ou de pulvérisation.
- Réfrigérant : L’hydrure de butyle refroidit et maintient de basses températures dans les systèmes de réfrigération à petite échelle tels que les réfrigérateurs et congélateurs domestiques, servant de réfrigérant.
- Fluide à briquet : L’hydrure de butyle alimente les briquets à cigarettes et les briquets torches, générant une flamme qui est un composant clé des fluides à briquet.
- Extraction : L’hydrure de butyle agit comme un solvant dans l’extraction des huiles essentielles et des composés végétaux des matières botaniques, dissolvant efficacement les composés souhaités.
- Utilisation en laboratoire : Les laboratoires utilisent l’hydrure de butyle comme combustible pour les becs Bunsen et la chromatographie en phase gazeuse.
- Gaz d’étalonnage : l’hydrure de butyle sert de gaz d’étalonnage pour les détecteurs et capteurs de gaz, offrant des propriétés bien définies et facilement mesurables.
- Soudage et brasage : Les chalumeaux à hydrure de butyle facilitent les opérations de soudage et de brasage grâce à leurs températures élevées, leur précision et leur convivialité.
- Loisirs : l’hydrure de butyle alimente les réchauds de camping portables et les lampes de poche, améliorant ainsi les activités récréatives de plein air telles que le camping, la randonnée et la cuisine.
- Source de consommation : L’hydrure de butyle sert de source de chaleur dans diverses applications, notamment les outils chauffants, les petits appareils de chauffage et les applications à base de flamme dans des industries spécifiques.
La nature polyvalente de l’hydrure de butyle et sa gamme d’applications en font un composé précieux dans plusieurs industries, articles ménagers et activités récréatives.
Question:
Q : Où puis-je acheter du gaz butane près de chez moi ?
R : Vous pouvez généralement trouver du gaz hydrure de butyle dans les quincailleries locales, les supermarchés ou les dépanneurs qui vendent des fournitures de camping.
Q : Le gaz butane est-il du gaz naturel ?
R : Non, l’hydrure de butyle n’est pas considéré comme du gaz naturel. Il s’agit d’un gaz d’hydrocarbure dérivé du traitement du pétrole ou du gaz naturel.
Q : Qu’est-ce que le butane ?
R : L’hydrure de butyle est un hydrocarbure gazeux de formule chimique C₄H₁₀. C’est un gaz inflammable incolore et inodore couramment utilisé comme carburant et dans diverses applications.
Q : Comment le butane est-il fabriqué ?
R : L’hydrure de butyle est principalement fabriqué par des processus tels que la distillation fractionnée du pétrole ou du gaz naturel, le craquage d’hydrocarbures plus lourds ou l’isomérisation d’autres hydrocarbures.
Q : Comment recharger un briquet au butane ?
R : Pour remplir un briquet à hydrure de butyle, localisez d’abord la valve de recharge, généralement en bas. Insérez la buse d’hydrure de butyle dans la valve et appuyez fermement pour libérer l’hydrure de butyle dans la lumière jusqu’à ce qu’elle soit pleine.
Q : Lequel des composés suivants est un isomère structural du butane ?
R : Le pentane (C₅H₁₂) est un isomère structural de l’hydrure de butyle, car les deux composés contiennent quatre atomes de carbone mais ont des arrangements différents.
Q : Comment recharger un briquet au butane ?
R : Pour recharger un briquet à hydrure de butyle, maintenez le briquet à l’envers, alignez la buse de la cartouche de recharge à hydrure de butyle avec la valve de recharge du briquet et appuyez fermement sur la cartouche pour libérer l’hydrure de butyle dans le briquet.
Q : Où acheter du butane près de chez moi ?
R : Vous pouvez acheter de l’hydrure de butyle dans les quincailleries locales, les supermarchés ou les dépanneurs qui stockent des fournitures de camping ou des articles ménagers.
Q : Où acheter du butane ?
R : L’hydrure de butyle peut être acheté auprès de diverses sources, notamment les détaillants en ligne, les quincailleries, les magasins de fournitures de camping et certains supermarchés.
Q : Quelle affirmation compare le mieux le point de fusion du butane (C₄H₁₀) à celui de l’octane (C₈H₁₈) ?
R : L’octane, avec une structure moléculaire plus grande et plus complexe, a généralement un point de fusion plus élevé que l’hydrure de butyle.
Q : Quelle est la masse molaire du butane, C₄H₁₀ ?
R : La masse molaire de l’hydrure de butyle (C₄H₁₀) est d’environ 58,12 grammes par mole.
Q : Combien d’isomères sont possibles pour C₄H₁₀ ?
R : L’hydrure de butyle (C₄H₁₀) possède deux isomères : le n-butane (butane normal) et l’isobutane (2-méthylpropane).
Q : Lesquels des composés C₄H₁₀, SrCl₂, Cr(NO₃)₃, OF₂ devraient exister sous forme de molécules ?
R : C₄H₁₀ (hydrure de butyle) et OF₂ (difluorure d’oxygène) devraient exister sous forme de molécules, tandis que SrCl₂ et Cr(NO₃)₃ sont des composés ioniques.
