Le butadiène (C4H6) est un composé chimique polyvalent. Il est utilisé dans la production de caoutchouc synthétique, de plastiques et de divers autres produits en raison de son élasticité et de sa résistance.
| Nom UICPA | buta-1,3-diène |
| Formule moléculaire | C4H6 |
| Numero CAS | 106-99-0 |
| Synonymes | Divinyle, biéthylène, buta-1,3-diène, vinyle éthylène, érythrène |
| InChI | InChI=1S/C4H6/c1-3-4-2/h3-4H,1-2H2 |
Propriétés du butadiène
Formule butadiène
La formule du butadiène est C4H6. Il est constitué de quatre atomes de carbone et de six atomes d’hydrogène. Cette formule moléculaire représente la disposition des atomes dans le butadiène et donne un aperçu de sa composition chimique.
Butadiène Masse molaire
La masse molaire du Buta-1,3-diène peut être calculée en additionnant les masses atomiques de ses éléments constitutifs. Le carbone a une masse molaire d’environ 12,01 g/mol et l’hydrogène a une masse molaire d’environ 1,01 g/mol. Par conséquent, la masse molaire du Buta-1,3-diène est d’environ 54,09 g/mol.
Point d’ébullition du butadiène
Le buta-1,3-diène a un point d’ébullition relativement bas par rapport à de nombreux autres composés. Il bout à environ -4,4 degrés Celsius ou 24,1 degrés Fahrenheit. Ce faible point d’ébullition permet une conversion facile du Buta-1,3-diène liquide à son état gazeux.
Butadiène Point de fusion
Contrairement à de nombreux composés organiques, le Buta-1,3-diène n’a pas de point de fusion distinct en raison de sa nature hautement réactive et de sa tendance à polymériser. Au lieu de cela, il existe sous forme de gaz incolore à température ambiante et à pression atmosphérique.
Densité du butadiène g/mL
La densité du Buta-1,3-diène est d’environ 0,63 g/mL. Cette valeur indique que le Buta-1,3-diène est moins dense que l’eau, qui a une densité de 1 g/mL. La faible densité du Buta-1,3-diène contribue à sa flottabilité et à sa capacité à former facilement des vapeurs.
Butadiène Poids moléculaire
Le poids moléculaire du Buta-1,3-diène est d’environ 54,09 g/mol. Cette valeur représente la masse moyenne d’une molécule de Buta-1,3-diène, en tenant compte des masses atomiques des atomes de carbone et d’hydrogène présents dans sa structure chimique.
Structure du butadiène
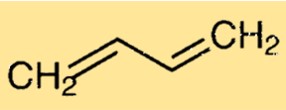
La structure du Buta-1,3-diène consiste en une chaîne de quatre atomes de carbone liés entre eux par des liaisons simples et doubles alternées. Chaque atome de carbone est également lié à deux atomes d’hydrogène. Cette structure linéaire confère au Buta-1,3-diène ses propriétés et sa réactivité caractéristiques.
Solubilité du butadiène
Le buta-1,3-diène est peu soluble dans l’eau mais se dissout facilement dans les solvants organiques tels que le benzène et le toluène. Sa faible solubilité dans l’eau est due aux différences de polarité entre le Buta-1,3-diène et les molécules d’eau.
| Apparence | Gaz incolore |
| Gravité spécifique | 0,62 – 0,63 |
| Couleur | Incolore |
| Odeur | Odeur légère et aromatique |
| Masse molaire | 54,09 g/mole |
| Densité | 0,62 – 0,63 g/mL |
| Point de fusion | -138,4°C (-217,1°F) |
| Point d’ébullition | -4,4°C (24,1°F) |
| Point d’éclair | -76°C (-105°F) |
| Solubilité dans l’eau | Insoluble |
| Solubilité | Soluble dans les solvants organiques (par exemple, benzène, toluène) |
| La pression de vapeur | 448 mmHg à 20°C |
| Densité de vapeur | 1,9 (Air = 1) |
| pKa | ~43 (estimé) |
| pH | Neutre |
Sécurité et dangers du butadiène
Le buta-1,3-diène présente certains risques pour la sécurité et des précautions doivent être prises lors de sa manipulation. Il est inflammable et peut former des mélanges explosifs avec l’air. Par conséquent, une ventilation adéquate et des mesures de prévention des incendies sont cruciales. Une exposition prolongée au Buta-1,3-diène peut provoquer une irritation des yeux, de la peau et du système respiratoire. Il est également considéré comme un cancérigène potentiel et l’exposition doit être minimisée. Des équipements de protection tels que des gants, des lunettes et des respirateurs doivent être utilisés lorsque vous travaillez avec le Buta-1,3-diène. Les déversements doivent être contenus et nettoyés rapidement. Il est important de suivre les directives de sécurité, telles que celles fournies par les agences de réglementation, pour garantir une manipulation et un stockage en toute sécurité du Buta-1,3-diène.
| Symboles de danger | Inflammable (F), Nocif (Xn), Cancérigène (C) |
| Description de la sécurité | Tenir à l’écart de la chaleur/des étincelles/des flammes nues. Utiliser dans des zones bien ventilées. Évitez une exposition prolongée. Manipuler avec des gants et des vêtements de protection. |
| Numéros d’identification de l’ONU | ONU 1010 |
| Code SH | 2903.14.00 |
| Classe de danger | 2.1 – Gaz inflammables |
| Groupe d’emballage | GE II |
| Toxicité | Considéré comme un cancérigène potentiel et peut provoquer une irritation respiratoire et cutanée. |
Méthodes de synthèse du butadiène
Il existe plusieurs méthodes de synthèse du Buta-1,3-diène, chacune ayant ses propres avantages et limites. Une méthode courante est le vapocraquage des hydrocarbures, tels que le naphta ou les liquides du gaz naturel.
Dans ce processus, le procédé chauffe la charge d’hydrocarbures à des températures élevées, généralement autour de 800 à 900 °C, en présence de vapeur. Cela conduit à la rupture des liaisons carbone-carbone et à la formation de Buta-1,3-diène.
Une autre méthode implique la déshydrogénation catalytique du butène ou des butanes. En utilisant des catalyseurs spécifiques, tels que des oxydes métalliques ou des métaux supportés, la réaction élimine sélectivement les atomes d’hydrogène du matériau de départ, entraînant la production de Buta-1,3-diène.
La dimérisation catalytique de l’acétylène donne également du Buta-1,3-diène. Ce processus implique la réaction de deux molécules d’acétylène pour former du Buta-1,3-diène, généralement en présence d’un catalyseur métallique comme le cuivre.
Des catalyseurs tels que l’alumine ou les zéolites facilitent la déshydratation de l’éthanol à des températures élevées. Ce processus forme activement du Buta-1,3-diène.
De plus, certaines usines produisent du buta-1,3-diène comme sous-produit de la production d’éthylène par le procédé de craquage du naphta ou du gazole. Cette méthode tire parti des réactions de craquage pour générer un mélange d’oléfines, dont le Buta-1,3-diène.
Ces méthodes de synthèse jouent un rôle crucial dans la production de Buta-1,3-diène, offrant diverses voies permettant de répondre à la demande de cet important produit chimique dans des industries telles que la fabrication du caoutchouc, des plastiques et des fibres synthétiques.
Utilisations du butadiène
Le buta-1,3-diène trouve une application dans un large éventail d’industries en raison de ses propriétés polyvalentes. Voici quelques utilisations clés du Buta-1,3-diène :
- Caoutchouc synthétique : La production de caoutchouc synthétique, tel que le caoutchouc styrène-buta-1,3-diène (SBR) et le caoutchouc polyButa-1,3-diène (PBR), utilise principalement du buta-1,3-diène. Ces caoutchoucs offrent une excellente élasticité, résilience et résistance à l’abrasion, ce qui les rend idéaux pour les pneus, les composants automobiles, les bandes transporteuses et les chaussures.
- Plastiques : le buta-1,3-diène est un monomère essentiel pour la fabrication de divers plastiques, notamment les plastiques acrylonitrile-buta-1,3-diène-styrène (ABS) et styrène-buta-1,3-diène (SB). Ces plastiques présentent une résistance aux chocs, une résistance à la chaleur et une stabilité dimensionnelle améliorées, ce qui les rend précieux pour les applications dans les biens de consommation, les appareils électroménagers et les pièces automobiles.
- Adhésifs : Les fortes capacités de liaison des polymères à base de buta-1,3-diène en font un composant précieux dans les formulations adhésives. Ils offrent une adhérence sur une large gamme de substrats, ce qui les rend utiles pour les applications de collage dans des secteurs tels que la construction, le travail du bois et l’emballage.
- Revêtements : Le buta-1,3-diène contribue à la production de revêtements et de peintures présentant des propriétés de durabilité, de flexibilité et d’adhérence améliorées. Les résines, telles que les résines époxy et alkyde, l’utilisent dans leur synthèse, constituant des composants essentiels des revêtements protecteurs pour les métaux, le béton et d’autres surfaces.
- Textiles et fibres : La production de fibres synthétiques, telles que les fibres d’acrylonitrile-Buta-1,3-diène (AB), utilise le Buta-1,3-diène. Ces fibres possèdent une résistance élevée, une bonne stabilité dimensionnelle et une résistance aux produits chimiques, ce qui les rend adaptées aux textiles, aux tapis et aux tissus industriels.
- Additifs pour carburant : Le buta-1,3-diène améliore l’indice d’octane de l’essence en tant qu’additif pour carburant utilisé dans sa production. Il améliore les propriétés de combustion de l’essence, ce qui entraîne une amélioration des performances du moteur et une réduction des émissions.
Ces applications mettent en évidence la vaste utilité du Buta-1,3-diène dans diverses industries, contribuant au développement de divers produits que nous rencontrons dans notre vie quotidienne.
Des questions:
Q : Qu’est-ce que le butadiène ?
R : Le buta-1,3-diène est un composé chimique de formule moléculaire C4H6, constitué d’une chaîne de quatre atomes de carbone et de deux doubles liaisons.
Q : Quel est le nom IUPAC du produit principal lorsque le 1,3-butadiène réagit avec des quantités égales de HCl ?
R : Le produit principal, selon la nomenclature IUPAC, est le 3-chlorobut-1-ène.
Q : La molécule 1,3-butadiène contient combien d’atomes d’H ?
R : Le buta-1,3-diène contient six atomes d’hydrogène (H) au total.
Q : Quelle est la relation entre les formes s-cis et s-trans du 1,3-butadiène ?
R : Les formes s-cis et s-trans du 1,3-butadiène sont des isomères géométriques, différant par la disposition des substituants autour des doubles liaisons.
Q : Quel est le nombre total de nœuds dans le ψ3 MO du 1,3-butadiène ?
R : L’orbitale moléculaire ψ3 du 1,3-butadiène contient un total de trois nœuds.
Q : Le butadiène possède combien d’OM de liaison ?
R : Le butadiène possède trois orbitales moléculaires (MO) de liaison formées à partir du chevauchement d’orbitales atomiques.
Q : Quelle est l’absorption attendue du butadiène ?
R : Le butadiène devrait absorber la lumière ultraviolette (UV) dans la plage d’environ 190 à 200 nm en raison de son système conjugué.
