Le bromure de zinc (ZnBr2) est un composé chimique. Il est formé d’éléments zinc et brome. Il est utilisé dans diverses applications telles que les fluides de forage pétrolier et les solutions électrolytiques.
| Nom UICPA | Bromure de zinc |
| Formule moléculaire | ZnBr2 |
| Numero CAS | 7699-45-8 |
| Synonymes | Dibromure de zinc, bromure de zinc (II) |
| InChI | InChI=1S/2BrH.Zn/h2*1H;/q;;+2/p-2 |
Propriétés du bromure de zinc
Formule de bromure de zinc
La formule du dibromure de zinc est ZnBr2. Il se compose d’un atome de zinc (Zn) et de deux atomes de brome (Br). Ce composé est formé par la combinaison de ces éléments.
Bromure De Zinc Masse molaire
Le dibromure de zinc a une masse molaire d’environ 225,19 g/mol. Cette valeur est calculée en additionnant les masses atomiques d’un atome de zinc et de deux atomes de brome dans le composé.
Point d’ébullition du bromure de zinc
Le point d’ébullition du dibromure de zinc est d’environ 464°C (867°F). A cette température, le composé passe de l’état liquide à l’état gazeux. Ce point d’ébullition élevé le rend adapté à certaines applications industrielles.
Point de fusion du bromure de zinc
Le dibromure de zinc a un point de fusion d’environ 394°C (741°F). C’est la température à laquelle le composé solide passe à l’état liquide. Le point de fusion relativement élevé est dû aux fortes interactions entre les atomes de zinc et de brome.
Densité du bromure de zinc g/mL
La densité du dibromure de zinc est d’environ 4,20 g/mL. Cette valeur indique la masse du composé par unité de volume. La densité élevée suggère que le dibromure de zinc est relativement lourd pour son volume.
Bromure De Zinc Poids moléculaire
Le poids moléculaire du dibromure de zinc est d’environ 225,19 g/mol. Cette valeur représente la somme des poids atomiques de tous les atomes d’une seule molécule du composé.
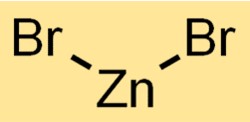
Structure du bromure de zinc
Le dibromure de zinc a une structure cristalline. Il forme un réseau dans lequel les cations zinc (Zn2+) sont entourés d’anions bromure (Br-) selon un motif répétitif. Cette structure contribue aux propriétés et au comportement du composé.
Solubilité du bromure de zinc
Le dibromure de zinc est très soluble dans l’eau. Lorsqu’il est ajouté à l’eau, il se dissocie en cations zinc et anions bromure, formant une solution. Cette solubilité est avantageuse dans diverses applications, notamment son utilisation comme électrolyte dans les batteries et dans la formulation de fluides de forage pour l’industrie pétrolière.
| Apparence | Solide blanc |
| Gravité spécifique | 4,20 g/ml |
| Couleur | Incolore |
| Odeur | Inodore |
| Masse molaire | 225,19 g/mole |
| Densité | 4,20 g/ml |
| Point de fusion | 394°C (741°F) |
| Point d’ébullition | 464°C (867°F) |
| Point d’éclair | N’est pas applicable |
| Solubilité dans l’eau | Très soluble, se dissocie en cations zinc et anions bromure |
| Solubilité | Soluble dans l’eau |
| Pression de vapeur | Pas bien défini |
| Densité de vapeur | N’est pas applicable |
| pKa | ~3,8 |
| pH | Acide |
Sécurité et dangers du bromure de zinc
Le dibromure de zinc présente certains risques pour la sécurité. Il peut provoquer une irritation de la peau et des yeux au contact. L’inhalation de ses poussières ou de ses vapeurs peut entraîner une gêne respiratoire. Il est essentiel de le manipuler avec précaution, en portant des équipements de protection comme des gants et des lunettes. En cas de contact avec la peau, laver à l’eau et consulter un médecin si l’irritation persiste. En cas d’ingestion, consultez immédiatement un médecin. Tenez-le à l’écart des matières incompatibles, des acides forts et des bases. Conserver dans un endroit bien ventilé, loin des flammes nues ou des sources de chaleur. Dans l’ensemble, il est crucial de suivre des mesures de sécurité appropriées lorsqu’il s’agit de dibromure de zinc afin d’éviter les risques potentiels.
| Symboles de danger | Corrosif, Nocif en cas d’ingestion |
| Description de la sécurité | Eviter le contact avec la peau et les yeux. Portez des vêtements et des gants de protection. En cas de contact, rincer abondamment. L’inhalation de poussières/vapeurs peut provoquer une irritation respiratoire. Conserver dans un endroit bien ventilé. Éviter le rejet dans l’environnement. Éliminez-le correctement. |
| Numéros d’identification de l’ONU | UN3264 |
| Code SH | 28275900 |
| Classe de danger | 8 (Substances corrosives) |
| Groupe d’emballage | II |
| Toxicité | Modérément toxique |
Méthodes de synthèse du bromure de zinc
Le dibromure de zinc peut être synthétisé par diverses méthodes. Une méthode courante consiste à faire réagir l’oxyde de zinc (ZnO) avec de l’acide bromhydrique (HBr) . La réaction produit du dibromure de zinc et de l’eau :
ZnO + 2HBr → ZnBr2 + H2O
Une autre approche est la réaction directe du zinc métallique avec le brome gazeux (Br2). Cette méthode donne du dibromure de zinc :
Zn + Br2 → ZnBr2
Le dibromure de zinc peut également être préparé en traitant le carbonate de zinc (ZnCO3) avec de l’acide bromhydrique :
ZnCO3 + 2HBr → ZnBr2 + H2O + CO2
De plus, la réaction de l’oxyde de zinc avec le bromure d’hydrogène gazeux (HBr) peut générer du dibromure de zinc :
ZnO + 2HBr → ZnBr2 + H2O
Ces méthodes de synthèse aboutissent à la formation de dibromure de zinc, un composé essentiel avec diverses applications industrielles, notamment son utilisation dans les solutions électrolytiques et les fluides de forage pétrolier.
Utilisations du bromure de zinc
Le dibromure de zinc trouve diverses applications importantes dans tous les secteurs en raison de ses propriétés uniques :
- Synthèse chimique : ZnBr2 sert de catalyseur dans les réactions chimiques. Il favorise des réactions spécifiques dans les processus de synthèse organique et de fabrication pharmaceutique.
- Photographie : Dans certains procédés photographiques, le ZnBr2 agit comme un matériau sensible à la lumière, contribuant à la production de papiers et de films photographiques.
- Industrie pétrolière et gazière : le ZnBr2 joue un rôle central dans les fluides de forage du secteur pétrolier et gazier, en maintenant la pression, en empêchant les éruptions de puits et en stabilisant les forages.
- Électrolyte de batterie : certains types de batteries, y compris les batteries à flux zinc-brome, utilisent le ZnBr2 comme électrolyte, servant aux systèmes de stockage d’énergie et d’alimentation de secours.
- Innovations médicinales : Les chercheurs explorent le potentiel du ZnBr2 dans les produits pharmaceutiques et les médicaments en raison de ses propriétés antimicrobiennes, en envisageant des applications dans la cicatrisation des plaies et le contrôle des infections.
- Amélioration des textiles : ZnBr2 trouve son utilité dans la teinture et l’impression de textiles en aidant à fixer des colorants spécifiques sur les tissus, améliorant ainsi la solidité des couleurs.
- Formulations ignifuges : ZnBr2 devient un additif dans les formulations ignifuges pour les plastiques et les textiles, réduisant efficacement l’inflammabilité de ces matériaux.
- Traitement de surface métallique : ZnBr2 participe aux traitements de surface métallique, utilisés dans les processus de nettoyage et de gravure qui préparent les surfaces aux revêtements ou traitements ultérieurs.
La nature polyvalente du ZnBr2 en fait une substance précieuse dans divers domaines, contribuant aux progrès technologiques et aux processus industriels.
Des questions:
Q : Le bromure de zinc est-il soluble ?
R : Oui, le dibromure de zinc est hautement soluble dans l’eau.
Q : Le bromure de zinc est-il ionique ou covalent ?
R : Le dibromure de zinc est un composé ionique.
Q : À quoi ressemble le bromure de zinc ?
R : Le dibromure de zinc apparaît comme un solide cristallin blanc.
Q : Quelle est la formule du bromure de zinc ?
R : La formule du dibromure de zinc est ZnBr2.
Q : Le ZnBr2 est-il soluble dans l’eau ?
R : Oui, le ZnBr2 est soluble dans l’eau.
Q : Qu’est-ce que le ZnBr2 ?
R : ZnBr2 est un composé chimique, le dibromure de zinc.
Q : Le ZnBr2 est-il ionique ou moléculaire ?
R : Le ZnBr2 est de nature ionique.
Q : Quelle masse de ZnBr2 pourriez-vous préparer à partir de 1,00 g de zinc ?
R : Vous pouvez préparer 1,76 g de ZnBr2 à partir de 1,00 g de zinc.
Q : Le ZnBr2 se dissout-il complètement dans l’eau ?
R : Oui, le ZnBr2 se dissout complètement dans l’eau.
Q : Quel(s) produit(s) se forment à la cathode lors de l’électrolyse d’une solution aqueuse de ZnBr2 ?
R : À la cathode, du zinc métallique se forme lors de l’électrolyse du ZnBr2.
Q : Que reste-t-il lorsque le ZnBr2 est dissous dans l’eau ?
R : Lorsque ZnBr2 est dissous dans l’eau, les ions Zn²⁺ et les ions bromure (Br⁻) restent dans la solution.
