Le bromure de magnésium (MgBr2) est un composé composé de Mg et Br. Il est couramment utilisé comme catalyseur dans les réactions de synthèse organique et comme sédatif en médecine.
| Nom UICPA | Bromure de magnésium |
| Formule moléculaire | MgBr2 |
| Numero CAS | 7789-48-2 |
| Synonymes | Dibromure de magnésium, UN1913, Bromomagnésite, Magnesium bromatum, Magnesiumbromid, Bromure de magnésium |
| InChI | InChI=1S/2BrH.Mg/h2*1H;/q;;+2/p-2 |
Propriétés du bromure de magnésium
Formule de bromure de magnésium
La formule chimique du bromure de magnésium est MgBr2. Cela indique que MgBr2 est composé d’un ion Mg+2 et de deux ions Br-. La formule représente le rapport des atomes dans une molécule et joue un rôle essentiel dans la détermination des propriétés d’un composé. La formule du bromure de magnésium indique qu’il s’agit d’un composé ionique avec un point de fusion et d’ébullition élevé et une forte liaison ionique entre les ions Mg+2 et Bri-.
Bromure De Magnésium Masse molaire
La masse molaire de MgBr2 est de 184,113 g/mol. C’est la somme des masses atomiques du magnésium et de deux atomes de brome. La masse molaire est un paramètre crucial dans les calculs chimiques car elle permet de déterminer le nombre de moles d’une substance dans une quantité donnée d’un échantillon. La masse molaire du MgBr2 joue un rôle essentiel dans la détermination de la quantité de composé nécessaire aux réactions chimiques.
Point d’ébullition du bromure de magnésium
Le MgBr2 a un point d’ébullition de 1 204 degrés Celsius ou 2 199 degrés Fahrenheit. Le point d’ébullition d’un composé est la température à laquelle sa pression de vapeur est égale à la pression atmosphérique. Le point d’ébullition élevé du MgBr2 indique qu’il s’agit d’un composé stable capable de résister à des températures élevées sans décomposition. Cette caractéristique le rend utile dans les applications à haute température telles que la métallurgie et les réactions de synthèse organique.
Point de fusion du bromure de magnésium
Le MgBr2 a un point de fusion de 714 degrés Celsius ou 1 317 degrés Fahrenheit. Le point de fusion d’un composé est la température à laquelle il passe de l’état solide à l’état liquide. Le point de fusion élevé du MgBr2 indique qu’il s’agit d’un composé stable doté de fortes forces intermoléculaires. Cette caractéristique le rend utile comme réactif dans les réactions chimiques à haute température.
Densité du bromure de magnésium g/mL
La densité du MgBr2 est de 3,72 g/mL. La densité est une mesure de la quantité de masse par unité de volume d’une substance. La densité élevée du MgBr2 indique qu’il s’agit d’un composé lourd qui peut couler dans l’eau. Cette caractéristique le rend utile dans diverses applications telles que la synthèse inorganique et comme sédatif en médecine.
Bromure De Magnésium Poids moléculaire
Le poids moléculaire du MgBr2 est de 184,113 g/mol. C’est la somme des masses atomiques du magnésium et de deux atomes de brome. Le poids moléculaire joue un rôle crucial dans la détermination des propriétés chimiques et physiques d’un composé. Le poids moléculaire du MgBr2 influence sa réactivité et sa solubilité dans divers solvants.
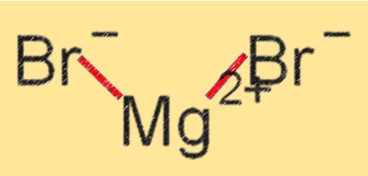
Structure du bromure de magnésium
MgBr2 a une structure de réseau cristallin avec les ions Mg+2 et Br- maintenus ensemble par des liaisons ioniques. C’est un solide cristallin blanc hautement soluble dans l’eau et d’autres solvants polaires. La structure du réseau cristallin du MgBr2 contribue à ses points de fusion et d’ébullition élevés, ainsi qu’à sa stabilité dans diverses réactions chimiques.
| Apparence | Solide cristallin blanc |
| Gravité spécifique | 3,72 g/ml |
| Couleur | Blanc |
| Odeur | Inodore |
| Masse molaire | 184,113 g/mole |
| Densité | 3,72 g/ml |
| Point de fusion | 714 °C (1 317 °F) |
| Point d’ébullition | 1 204 °C (2 199 °F) |
| Point d’éclair | N’est pas applicable |
| Solubilité dans l’eau | Très soluble |
| Solubilité | Soluble dans l’eau, l’éthanol, l’acétone et l’éther |
| Pression de vapeur | N’est pas applicable |
| Densité de vapeur | N’est pas applicable |
| pKa | N’est pas applicable |
| pH | Neutre |
Sécurité et dangers du bromure de magnésium
Le MgBr2 est généralement considéré comme sûr lorsqu’il est manipulé correctement. Cependant, comme tout composé chimique, il peut présenter des dangers s’il n’est pas manipulé avec précaution. Le MgBr2 est corrosif et peut provoquer de graves irritations de la peau et des yeux. L’inhalation de poussières ou de fumées de MgBr2 peut provoquer une irritation respiratoire. Il est important de porter des vêtements de protection et un équipement respiratoire lors de la manipulation du MgBr2. Le MgBr2 peut également réagir violemment avec certains produits chimiques, tels que l’eau ou les acides, produisant du bromure d’hydrogène gazeux. Par conséquent, il est crucial de stocker et de manipuler le MgBr2 à l’écart des substances incompatibles et dans un endroit bien ventilé.
| Symboles de danger | Corrosif |
| Description de la sécurité | Eviter le contact avec la peau et les yeux. Porter des vêtements de protection et un équipement respiratoire. Manipuler et stocker à l’écart des substances incompatibles. |
| Numéros d’identification de l’ONU | UN2920 |
| Code SH | 2827.59.90 |
| Classe de danger | 8 |
| Groupe d’emballage | II |
| Toxicité | Faible toxicité si manipulé correctement. Peut provoquer une irritation de la peau et des yeux. L’inhalation de poussières ou de fumées peut provoquer une irritation respiratoire. |
Méthodes de synthèse du bromure de magnésium
Le MgBr2 peut être synthétisé par plusieurs méthodes.
Une méthode courante est la réaction entre le magnésium métallique et le bromure d’hydrogène gazeux. Ce processus consiste à faire passer du bromure d’hydrogène gazeux sur du métal Mg, produisant ainsi du MgBr2 et de l’hydrogène gazeux.
Une autre méthode est la réaction entre l’oxyde de magnésium ou l’hydroxyde de magnésium et l’acide bromhydrique . Ce processus produit du MgBr2 et de l’eau comme produits.
De plus, MgBr2 peut être synthétisé par la réaction entre le carbonate de magnésium et l’acide bromhydrique , ou par la réaction entre le sulfate de magnésium et le NaBr.
Ces méthodes consistent à mélanger les réactifs et à laisser la réaction se dérouler, entraînant la formation de MgBr2.
Utilisations du bromure de magnésium
Le MgBr2 a diverses utilisations dans diverses industries. Voici quelques-unes de ses applications courantes :
- En synthèse organique : Utilisé comme catalyseur acide de Lewis dans les réactions de synthèse organique, comme la réaction de Grignard, qui implique la formation de liaisons carbone-carbone.
- Dans la production de retardateurs de flamme : Les retardateurs de flamme, qui rendent les matériaux moins inflammables, en dépendent comme composant crucial dans leur production.
- Dans l’industrie pétrolière et gazière : Utilisé comme fluide de complétion dans les puits de pétrole et de gaz, ce qui aide à maintenir la pression et empêche l’effondrement du puits.
- Dans les produits pharmaceutiques : utilisé comme ingrédient actif dans certains produits pharmaceutiques, tels que les sédatifs et les anticonvulsivants.
- En électrochimie : Utilisé comme électrolyte dans les batteries et autres appareils électrochimiques.
- Dans la production de métaux : utilisé comme fondant dans la production de certains métaux, comme l’aluminium et le titane.
- En chimie analytique : Utilisé comme réactif en chimie analytique pour la détermination de divers éléments, tels que le bore et le fluorure.
Des questions:
Q : Quelle est la formule chimique du bromure de magnésium ?
R : La formule chimique du bromure de magnésium est MgBr2.
Q : Le bromure de magnésium est-il ionique ou covalent ?
R : MgBr2 est un composé ionique.
Q : Quelle est la formule du bromure de magnésium ?
R : La formule du bromure de magnésium est MgBr2.
Q : Le bromure de magnésium est-il soluble dans l’eau ?
R : Oui, MgBr2 est soluble dans l’eau. Il est très soluble dans l’eau et peut se dissoudre pour former une solution claire et incolore.
Q : Quelle est la formule du bromure de magnésium ?
R : La formule du bromure de magnésium est MgBr2.
