Le bromure de calcium est un composé chimique de formule CaBr2. C’est un solide blanc, inodore et soluble qui est utilisé dans diverses industries comme source d’ions bromure.
| Nom de l’UICPA | Bromure de calcium |
| Formule moléculaire | CaBr2 |
| Numero CAS | 7789-41-5 |
| Synonymes | Dibromure de calcium ; Bromocalcium |
| InChI | InChI=1S/Ca.2BrH/h;2*1H/q+2;;/p-2 |
Propriétés du bromure de calcium
Formule de bromure de calcium
La formule chimique du bromure de calcium est CaBr2. Cette formule indique qu’un ion calcium est lié à deux ions bromure par des liaisons ioniques. La formule d’un composé représente les types et le nombre d’atomes présents dans une molécule ou une unité de formule du composé.
Bromure De Calcium Masse molaire
La masse molaire de CaBr2 est de 199,89 g/mol. Cette valeur est calculée en additionnant les masses atomiques d’un atome de calcium (40,08 g/mol) et de deux atomes de brome (79,90 g/mol chacun). La masse molaire est une propriété cruciale de tout composé chimique car elle détermine la quantité de substance présente dans une mole du composé.
Point d’ébullition du bromure de calcium
Le point d’ébullition du CaBr2 est de 1 193 °C (2 179 °F). CaBr2 a un point d’ébullition élevé en raison de sa nature ionique. Les composés ioniques ont de fortes forces électrostatiques entre leurs ions chargés positivement et négativement. Ces forces nécessitent beaucoup d’énergie pour se briser, ce qui entraîne un point d’ébullition élevé.
Point de fusion du bromure de calcium
Le point de fusion du CaBr2 est de 730 °C (1 346 °F). Le point de fusion d’un composé est la température à laquelle il passe de l’état solide à l’état liquide. CaBr2 a un point de fusion relativement élevé en raison de sa nature ionique. Les fortes forces électrostatiques entre ses ions nécessitent beaucoup d’énergie pour être surmontées, ce qui entraîne un point de fusion élevé.
Densité du bromure de calcium g/mL
La densité de CaBr2 est de 3,353 g/mL. La densité est la masse d’une substance par unité de volume. La haute densité de CaBr2 est due à sa nature ionique et à la disposition serrée de ses ions.
Bromure De Calcium Poids moléculaire
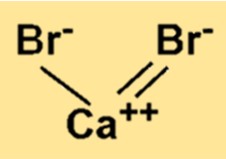
Le poids moléculaire de CaBr2 est de 199,89 g/mol. Cette valeur est calculée en additionnant les masses atomiques d’un atome de calcium et de deux atomes de brome. Le poids moléculaire est une propriété essentielle de tout composé chimique car il détermine la quantité de substance présente dans une molécule du composé.
Structure du bromure de calcium
CaBr2 a une structure de réseau cristallin composée d’ions Ca2+ et Br−. Les ions Ca2+ sont entourés de six ions Br−, et chaque ion Br− est entouré de six ions Ca2+. Cet arrangement d’ions se traduit par une forte liaison ionique entre eux.
| Apparence | Solide blanc |
| Gravité spécifique | 3,353 g/mL |
| Couleur | Incolore |
| Odeur | Inodore |
| Masse molaire | 199,89 g/mole |
| Densité | 3,353 g/mL |
| Point de fusion | 730 °C (1 346 °F) |
| Point d’ébullition | 1 193 °C (2 179 °F) |
| Point d’éclair | N’est pas applicable |
| Solubilité dans l’eau | Très soluble |
| Solubilité | Soluble dans l’alcool, l’acétone et l’éther |
| La pression de vapeur | Pas disponible |
| Densité de vapeur | Pas disponible |
| pKa | N’est pas applicable |
| pH | 7 (neutre) |
Sécurité et dangers du bromure de calcium
Le CaBr2 est généralement considéré comme sûr lorsqu’il est manipulé correctement. Cependant, il peut présenter certains risques pour la santé s’il n’est pas manipulé ou utilisé correctement. L’inhalation ou l’ingestion de CaBr2 peut irriter respectivement les voies respiratoires et le tractus gastro-intestinal. Un contact cutané prolongé avec CaBr2 peut provoquer une irritation et une dermatite. Le CaBr2 peut également réagir violemment avec des agents oxydants puissants, libérant des gaz toxiques. Un équipement de protection individuelle approprié, tel que des gants et des lunettes, doit être porté lors de la manipulation du CaBr2. Il doit également être stocké dans un endroit frais, sec et bien ventilé, à l’écart des substances incompatibles.
| Symboles de danger | Aucun |
| Description de la sécurité | Provoque une irritation cutanée. Provoque une grave irritation des yeux. Nocif en cas d’ingestion ou d’inhalation. Peut provoquer une irritation respiratoire. |
| Numéros d’identification de l’ONU | UN3261 |
| Code SH | 28275900 |
| Classe de danger | 8 (corrosif) |
| Groupe d’emballage | III |
| Toxicité | Toxicité faible à modérée. |
Méthodes de synthèse du bromure de calcium
Il existe différentes méthodes pour synthétiser CaBr2, mais la plus courante implique la réaction entre le carbonate de calcium ou l’hydroxyde de calcium et l’acide bromhydrique . Ce processus produit du CaBr2 et de l’eau comme seul sous-produit. La réaction se déroule dans un environnement contrôlé avec agitation et chauffage constants pour assurer une conversion complète des réactifs.
Une autre méthode implique la réaction entre l’oxyde de calcium et l’acide bromhydrique . Ce processus produit également du CaBr2 et de l’eau comme sous-produit. La réaction est similaire à la première méthode et nécessite une agitation et un chauffage constants.
Une troisième méthode implique la réaction entre le calcium et le brome. La grande réactivité du brome et la nécessité d’une manipulation soigneuse rendent cette méthode moins couramment utilisée. La réaction produit du CaBr2 comme seul produit.
Toutes ces méthodes nécessitent une manipulation soigneuse et des précautions de sécurité, car elles impliquent des produits chimiques dangereux et des réactions potentiellement dangereuses. Le CaBr2 synthétisé doit être purifié avant utilisation pour éliminer toute impureté et garantir sa pureté. La pureté du produit final détermine sa qualité et son efficacité pour l’application envisagée.
Utilisations du bromure de calcium
CaBr2 trouve diverses applications dans différentes industries en raison de ses propriétés chimiques uniques. Certaines des utilisations courantes de CaBr2 sont :
- Industrie pétrolière et gazière : Utilisé dans l’industrie pétrolière et gazière comme fluide de complétion pour contrôler les pressions des puits de forage pendant les opérations de forage et de complétion.
- Médecine : Utilisé en médecine comme médicament sédatif et anticonvulsivant pour traiter l’épilepsie et d’autres troubles du système nerveux.
- Photographie : Utilisé en photographie comme sensibilisant pour la préparation d’émulsions de bromure d’argent.
- Synthèse chimique : utilisé comme catalyseur dans diverses réactions chimiques, notamment l’estérification, l’alkylation et la condensation.
- Ignifuge : Utilisé comme ignifuge dans les plastiques, les textiles et d’autres matériaux pour réduire le risque d’incendie.
- Industrie alimentaire : utilisé comme conservateur alimentaire pour prévenir la croissance microbienne et la détérioration.
- Réfrigération : Utilisé comme réfrigérant dans les systèmes de réfrigération à absorption.
- Traitement de l’eau : Utilisé dans le traitement de l’eau pour prévenir la croissance d’algues et de bactéries dans les piscines et autres systèmes d’eau.
Des questions:
Q : Quelle formule représente le composé bromure de calcium ?
R : La formule chimique du bromure de calcium est CaBr2.
Q : Le bromure de calcium est-il soluble dans l’eau ?
R : Oui, CaBr2 est soluble dans l’eau. Il a une solubilité élevée dans l’eau, avec une solubilité d’environ 121 g/100 mL à 20°C.
Q : Le bromure de calcium est-il aqueux ?
R : CaBr2 peut exister à l’état aqueux lorsqu’il est dissous dans l’eau, formant une solution aqueuse.
Q : Le bromure de calcium est-il soluble ?
R : Oui, CaBr2 est soluble dans divers solvants, notamment l’eau, l’éthanol et l’acétone.
Q : Quel précipité se forme lorsque des solutions aqueuses de bromure de calcium et de phosphate de potassium sont mélangées ?
R : Lorsque des solutions aqueuses de CaBr2 et de phosphate de potassium sont mélangées, un précipité blanc de phosphate de calcium se forme. L’équation chimique équilibrée de cette réaction est :
CaBr2(aq) + K3PO4(aq) → 2KBr(aq) + Ca3(PO4)2(s)
