Le brome (Br2) est une molécule diatomique composée de deux atomes de brome. C’est un liquide brun rougeâtre à température ambiante et très réactif. Il est utilisé dans diverses industries, notamment les produits pharmaceutiques, l’agriculture et le traitement de l’eau.
| Nom UICPA | Brome |
| Formule moléculaire | Br2 |
| Numero CAS | 7726-95-6 |
| Synonymes | Bromo, Brome moléculaire, UN 1744, Brome diatomique, Brome-79, Brome-81 |
| InChI | InChI=1S/Br2/c1-2 |
Propriétés du brome
Formule de brome
La formule chimique du brome est Br2. Cela signifie qu’une molécule de brome contient deux atomes de brome. La formule est utilisée pour représenter la composition d’une substance et elle est essentielle dans les réactions chimiques. La formule du brome est utilisée dans diverses industries, notamment les produits pharmaceutiques, le traitement de l’eau et l’agriculture.
Brome Masse molaire
La masse molaire de Br2 est de 159,808 g/mol. C’est la masse d’une mole de molécules Br2. La masse molaire est une propriété essentielle en chimie, car elle permet de déterminer la quantité de substance nécessaire pour une réaction donnée. Il est également utilisé pour convertir les grammes et les moles d’une substance.
Point d’ébullition du brome
Br2 a un point d’ébullition de 58,8 °C (137,8 °F). C’est la température à laquelle Br2 passe d’un liquide à un gaz. Le faible point d’ébullition du Br2 est dû à ses faibles forces intermoléculaires, qui permettent aux molécules de s’échapper plus facilement de l’état liquide. La haute réactivité du Br2 en fait une substance dangereuse à manipuler à haute température.
Point de fusion du brome
Le point de fusion du Br2 est de -7,2 °C (19,0 °F). C’est la température à laquelle le Br2 solide passe à l’état liquide. Le faible point de fusion du Br2 est dû à ses faibles forces intermoléculaires, qui permettent aux molécules de se déplacer plus facilement à l’état solide. Br2 a la propriété unique d’exister sous forme liquide à température ambiante, ce qui est rare parmi les halogènes.
Densité du brome g/mL
La densité de Br2 est de 3,12 g/mL. Cela signifie qu’un millilitre de Br2 a une masse de 3,12 grammes. La haute densité de Br2 est due à son poids moléculaire et à l’étroitesse de ses molécules à l’état liquide. La haute densité de Br2 le rend utile dans les réactions de synthèse organiques lourdes.
Brome Poids moléculaire
Le poids moléculaire de Br2 est de 79,90 g/mol. C’est la somme des poids atomiques des deux atomes de Br dans la molécule Br2. Le poids moléculaire est une propriété essentielle en chimie, car il permet de déterminer la quantité de substance nécessaire pour une réaction donnée.
Structure du brome
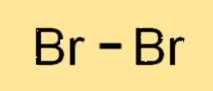
Br2 est une molécule diatomique, ce qui signifie qu’elle est constituée de deux atomes de Br liés ensemble. Les deux atomes Br2 partagent une paire d’électrons formant une liaison covalente. La molécule Br2 a une structure linéaire, avec les deux atomes de Br disposés en ligne droite. La structure du Br2 est similaire à celle d’autres halogènes tels que le chlore et l’iode.
| Apparence | Liquide brun rougeâtre |
| Gravité spécifique | 3,12 g/ml |
| Couleur | Brun rougeâtre |
| Odeur | Odeur âcre et irritante |
| Masse molaire | 159,808 g/mole |
| Densité | 3,12 g/ml |
| Point de fusion | -7,2 °C (19,0 °F) |
| Point d’ébullition | 58,8 °C (137,8 °F) |
| Point d’éclair | Ininflammable |
| Solubilité dans l’eau | 3,41 g/100 ml (25 °C) |
| Solubilité | Soluble dans le chloroforme, le tétrachlorure de carbone et l’éther |
| Pression de vapeur | 1,13 kPa à 25 °C |
| Densité de vapeur | 5,4 g/L |
| pKa | -5 |
| pH | N’est pas applicable |
Sécurité et dangers du brome
Le Br2 est un produit chimique dangereux et doit être manipulé avec précaution. C’est un liquide corrosif qui peut provoquer de graves irritations de la peau et des yeux. L’inhalation de vapeurs de Br2 peut entraîner des problèmes respiratoires et l’exposition à des niveaux élevés peut être mortelle. Le Br2 est également un agent oxydant puissant et peut réagir violemment avec des matériaux inflammables, provoquant des incendies ou des explosions. Un équipement de protection approprié, tel que des gants, des lunettes et des respirateurs, doit toujours être porté lorsque vous travaillez avec du Br2. Il doit être stocké dans un endroit frais, sec et bien ventilé, à l’écart des sources de chaleur et des matériaux incompatibles. En cas de déversement ou d’accident, évacuez immédiatement la zone et suivez les procédures de nettoyage appropriées.
| Symboles de danger | Crâne et os croisés, Corrosif |
| Description de la sécurité | Très toxique, corrosif et irritant pour la peau, les yeux et le système respiratoire. |
| Numéros d’identification de l’ONU | UN1744 |
| Code SH | 2801.30 |
| Classe de danger | 8 |
| Groupe d’emballage | II |
| Toxicité | DL50 (orale, rat) = 2 à 3 mg/kg |
Méthodes de synthèse du brome
Différentes méthodes permettent de synthétiser du Br2, en fonction de la pureté et de la quantité souhaitées.
Une méthode implique le traitement de la saumure avec du chlore gazeux en présence d’un catalyseur tel que le fer. La solution résultante d’hypochlorite de sodium et de chlorure de sodium est ensuite acidifiée avec de l’acide chlorhydrique, qui libère du gaz Br2.
Une autre méthode implique l’oxydation du bromure d’hydrogène gazeux avec de l’oxygène gazeux en présence d’un catalyseur tel que le platine ou l’amiante. Les industries utilisent couramment cette méthode pour produire du Br2 de haute pureté pour leurs applications.
L’électrolyse extrait le Br2 de la saumure en faisant passer un courant électrique à travers la solution, ce qui sépare les ions sodium et chlorure et produit du gaz Br2 comme sous-produit.
Utilisations du brome
Br2 a plusieurs utilisations importantes dans diverses industries, notamment :
- Les fabricants utilisent des composés à base de Br comme ignifugeants dans les textiles, les plastiques et les équipements électroniques afin de réduire le risque d’incendie en empêchant la propagation des flammes.
- Les sociétés pharmaceutiques incorporent des composés à base de Br dans la production de divers sédatifs, tranquillisants et analgésiques.
- Les usines de traitement de l’eau utilisent des composés à base de Br comme désinfectant pour tuer efficacement les bactéries, virus et autres organismes nuisibles.
- Les producteurs de pesticides et d’herbicides utilisent des composés à base de Br pour lutter efficacement contre les ravageurs et les mauvaises herbes.
- L’industrie pétrolière et gazière utilise des composés à base de Br dans les opérations de forage pour contrôler la corrosion et améliorer la récupération du pétrole.
- Les producteurs utilisent des composés à base de Br dans la production de films et de papiers photographiques pour contrôler efficacement la sensibilité et le contraste des images.
- Les réactions de synthèse chimique utilisent Br2 comme réactif pour produire des colorants, des plastiques et des produits pharmaceutiques.
Des questions:
Q : Br2 est-il polaire ou non polaire ?
R : Br2 est une molécule non polaire car les deux atomes de brome ont la même électronégativité, ce qui entraîne un partage égal des électrons dans la liaison covalente.
Q : Quel composé contient le plus probablement des liaisons covalentes polaires ? NaCl, AlF3, Br2, NF3 ?
R : Le composé qui contient le plus probablement des liaisons covalentes polaires est le NF3 (trifluorure d’azote), car les atomes d’azote et de fluor ont des électronégativités très différentes, ce qui entraîne un partage inégal des électrons dans la liaison covalente.
Q : Quel est ΔH0 pour cette réaction ? Br2 (g) → Br2 (l), ΔHf° Br2 (g) = 30,91 kJ/mol
R : Le ΔH0 pour la réaction est de -10,57 kJ/mol, car la chaleur de vaporisation du Br2 est de 41,48 kJ/mol et la chaleur de fusion est de 30,91 kJ/mol (donnée dans la question).
Q : Le Br2 est-il un gaz ?
R : Br2 peut exister à l’état gazeux et liquide en fonction des conditions de température et de pression. À température ambiante et pression standard, Br2 est un liquide brun rougeâtre.
Q : À quoi sert le brome ?
R : Le brome a plusieurs utilisations importantes dans diverses industries, notamment les retardateurs de flamme, le traitement de l’eau, les produits pharmaceutiques, les pesticides, l’industrie pétrolière et gazière, la photographie et la synthèse chimique.
Q : Le brome est-il un métal ?
R : Non, le brome n’est pas un métal. C’est un élément non métallique du groupe halogène du tableau périodique.
