Le borohydrure de sodium (NaBH4) est une poudre cristalline blanche utilisée comme agent réducteur en synthèse organique et comme source d’hydrogène pour les piles à combustible. Il est très réactif et sensible à l’eau.
| Nom UICPA | Tétrahydroborate de sodium |
| Formule moléculaire | NaBH4 |
| Numero CAS | 16940-66-2 |
| Synonymes | Borohydrure de sodium, tétrahydridoborate de sodium, borohydrure de sodium hydraté, tétrahydroborate de sodium hydraté |
| InChI | InChI=1S/BH4.Na/h1H4;/q+1;-1 |
Propriétés du borohydrure de sodium
Point d’ébullition du borohydrure de sodium
Le borohydrure de sodium n’a pas de point d’ébullition bien défini car il se décompose lorsqu’il est chauffé. La température de décomposition dépend des conditions de température et de pression.
Point de fusion du borohydrure de sodium
Le borohydrure de sodium a un point de fusion de 240 à 242°C. À cette température, la forme solide de NaBH4 passe à l’état liquide.
Densité du borohydrure de sodium g/ml
La densité du borohydrure de sodium est de 1,33 g/ml. C’est un solide cristallin blanc relativement dense par rapport à d’autres substances.
Masse molaire de Borohydrure de Sodium
La masse molaire du Borohydrure de Sodium (NaBH4) est 37,83 g/mol. Il est calculé en additionnant les masses atomiques de tous les atomes présents dans la formule moléculaire du NaBH4 (1 atome de sodium, 1 atome de bore et 4 atomes d’hydrogène).
Poids moléculaire du borohydrure de sodium
Le poids moléculaire du borohydrure de sodium est de 37,83 g/mol. Il s’agit de la somme des masses atomiques des atomes individuels dans la formule moléculaire de NaBH4.
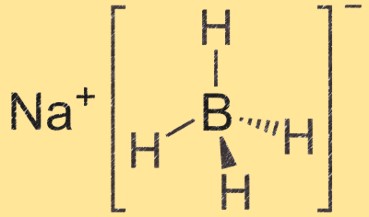
Structure du borohydrure de sodium
Le borohydrure de sodium est une molécule tétraédrique avec un ion sodium au centre et quatre groupes hydrure de bore qui y sont attachés. L’atome de bore est lié à quatre atomes d’hydrogène, créant ainsi une structure tétraédrique.
Formule de borohydrure de sodium
La formule chimique du tétrahydroborate de sodium est NaBH4. Il est composé d’un atome de sodium (Na), d’un atome de bore (B) et de quatre atomes d’hydrogène (H). Cette formule représente la composition chimique de cette substance et sa composition élémentaire.
| Apparence | Poudre cristalline blanche |
| Gravité spécifique | 1,33 g/ml |
| Couleur | Blanc |
| Odeur | Inodore |
| Masse molaire | 37,83 g/mole |
| Densité | 1,33 g/ml |
| Point de fusion | 240-242°C |
| Point d’ébullition | Se décompose en chauffant |
| Point d’éclair | N’est pas applicable |
| Solubilité dans l’eau | Soluble dans l’eau |
| Solubilité | Soluble dans les solvants organiques |
| La pression de vapeur | N’est pas applicable |
| Densité de vapeur | N’est pas applicable |
| pKa | N’est pas applicable |
| pH | N’est pas applicable |
Sécurité et dangers du borohydrure de sodium
Le tétrahydroborate de sodium est inflammable et réactif avec l’eau. Il peut libérer de l’hydrogène gazeux, inflammable, et former des mélanges explosifs avec l’air. Le tétrahydroborate de sodium est également un irritant cutané et oculaire. Une ventilation adéquate et un équipement de protection individuelle doivent être utilisés pour minimiser l’exposition lors de la manipulation du tétrahydroborate de sodium. Conservez-le dans un endroit frais et sec, à l’écart des sources d’inflammation et de l’eau.
| Symboles de danger | Inflammable, Irritant |
| Description de la sécurité | S26, S36/37 |
| Numéros d’identification de l’ONU | UN3375 |
| Code SH | 2827.90.90 |
| Classe de danger | 4.3 |
| Groupe d’emballage | II |
| Toxicité | Modérément toxique par ingestion, inhalation et contact cutané |
Méthodes de synthèse du borohydrure de sodium
Le borohydrure de sodium (NaBH4) peut être synthétisé par plusieurs méthodes, notamment :
- Réduction du sodium métallique : Cette méthode implique la réduction du trioxyde de bore (B2O3) avec du sodium métallique pour produire du NaBH4.
- Réduction de l’hydrure de sodium : l’hydrure de sodium (NaH) peut être utilisé pour réduire les trihalogénures de bore afin de produire du NaBH4.
- Réduction de l’hydrure de lithium et d’aluminium : l’hydrure de lithium et d’aluminium (LiAlH4) peut être utilisé pour réduire les halogénures de bore afin de produire du NaBH4.
- Hydrogénation : Le borohydrure de sodium peut être synthétisé par hydrogénation du borohydrure de sodium (NaBH3H).
Un équipement spécialisé et un personnel formé dans un environnement bien ventilé doivent exécuter toutes ces méthodes car le tétrahydroborate de sodium est inflammable et réactif. La méthode de synthèse sélectionnée dépendra des considérations de rendement, de pureté et de coût souhaitées.
Utilisations du borohydrure de sodium
Le tétrahydroborate de sodium (NaBH4) est un agent réducteur polyvalent et possède une large gamme d’applications dans divers domaines. Certaines des utilisations courantes du tétrahydroborate de sodium sont :
- Synthèse organique : NaBH4 est utilisé dans la réduction des composés carbonylés, des esters, des nitriles et des amides en leurs alcools, aldéhydes et amines correspondants.
- Produits pharmaceutiques : Le tétrahydroborate de sodium est utilisé dans la synthèse de divers ingrédients pharmaceutiques actifs et dans la préparation de composés chiraux.
- Science des polymères : NaBH4 est utilisé dans la réduction des résines époxy et des résines polyester insaturées.
- Environnement : Le tétrahydroborate de sodium peut être utilisé dans le traitement des eaux usées pour réduire les polluants tels que les métaux lourds et les colorants.
- Industrie alimentaire : NaBH4 est utilisé comme agent réducteur dans la production de pâtes à tartiner faibles en gras, de crème glacée et de chocolat.
Dans l’ensemble, le tétrahydroborate de sodium s’est avéré être un outil précieux dans le domaine de la synthèse chimique en raison de ses propriétés réductrices douces et de sa capacité à réduire sélectivement les groupes fonctionnels dans les structures moléculaires complexes.
Des questions:
Lequel de ces composés peut être réduit par le borohydrure de sodium ? cochez toutes les réponses qui s’appliquent.
Le tétrahydroborate de sodium (NaBH4) peut réduire un large éventail de composés, notamment :
- Composés carbonylés, tels que les aldéhydes et les cétones
- Nitriles
- Esters
- Amides
- Résines époxydes
- Résines polyester insaturées
- Certains colorants
- Métaux lourds
- Composés chiraux
Il est important de noter que les conditions spécifiques et les paramètres de réaction peuvent affecter l’efficacité de la réduction et la sélectivité du processus de réduction. De plus, tous les composés ne conviennent pas à la réduction avec le tétrahydroborate de sodium, car certains peuvent subir des réactions secondaires indésirables.
Pourquoi est-il important d’exposer le borohydrure de sodium à l’humidité ?
L’exposition du tétrahydroborate de sodium (NaBH4) à l’humidité est importante pour plusieurs raisons :
- Réactivité : Le tétrahydroborate de sodium est très réactif et peut se décomposer rapidement en présence d’humidité, générant de l’hydrogène gazeux et de la chaleur. Cela peut présenter un risque d’explosion et d’incendie s’il n’est pas manipulé correctement.
- Hydrolyse : le tétrahydroborate de sodium s’hydrolyse facilement en présence d’humidité pour former du tétrahydroborate de sodium hydraté (NaBH4.xH2O), qui a des propriétés réductrices réduites par rapport à la forme anhydre.
- Stabilité au stockage : L’humidité peut provoquer la décomposition progressive du tétrahydroborate de sodium, réduisant ainsi sa durée de conservation et son efficacité en tant qu’agent réducteur.
Par conséquent, il est important de conserver le borohydrure de sodium dans un récipient sec et hermétique et de le manipuler dans un environnement bien ventilé afin de minimiser l’exposition à l’humidité. Si l’exposition à l’humidité est inévitable, l’utilisation d’agents éliminant l’humidité ou d’atmosphères protectrices peut contribuer à minimiser ses effets sur la stabilité et la réactivité du tétrahydroborate de sodium.
Le borohydrure de sodium est-il un catalyseur ?
Le tétrahydroborate de sodium (NaBH4) n’est généralement pas considéré comme un catalyseur, mais plutôt comme un agent réducteur. Un catalyseur est une substance qui accélère une réaction chimique sans subir elle-même de changement permanent. Le tétrahydroborate de sodium se transforme chimiquement à mesure qu’il se réduit, se consommant dans la réaction de réduction.
Les réactions de synthèse et de réduction organiques utilisent couramment le tétrahydroborate de sodium comme source d’ions hydrure (H-). Le tétrahydroborate de sodium transfère ces ions hydrure à la molécule de substrat, réduisant ainsi les groupes fonctionnels tels que les carbonyles, les nitriles et les esters. Malgré son rôle d’agent réducteur, le tétrahydroborate de sodium peut jouer un rôle secondaire en tant qu’accepteur de protons, ce qui en fait une base douce qui peut influencer les conditions de réaction et affecter le résultat de la réaction.
Quel gaz inflammable est produit si le borohydrure de sodium est mélangé à de l’eau ?
Si le tétrahydroborate de sodium (NaBH4) est mélangé à de l’eau, il subit une hydrolyse rapide pour former du borohydrure de sodium hydraté (NaBH4.xH2O) et de l’hydrogène gazeux. L’hydrogène gazeux produit est inflammable et peut présenter un risque d’explosion et d’incendie s’il n’est pas manipulé correctement.
La réaction entre le tétrahydroborate de sodium et l’eau peut être exothermique et générer de la chaleur, ce qui peut encore accélérer le taux d’hydrolyse et augmenter la libération d’hydrogène gazeux. La réaction peut également générer un volume important de gaz en peu de temps, créant un risque de surpression et d’explosion.
Par conséquent, il est important de manipuler le tétrahydroborate de sodium dans un environnement bien ventilé et d’éviter de l’exposer à l’humidité ou à l’eau. Si l’exposition à l’humidité est inévitable, l’utilisation d’agents éliminant l’humidité ou d’atmosphères protectrices peut contribuer à minimiser le taux d’hydrolyse et la libération d’hydrogène gazeux.
Combien de moles de camphre réagissent avec le borohydrure de sodium ?
Le nombre de moles de camphre qui réagiront avec le tétrahydroborate de sodium (NaBH4) dépend de plusieurs facteurs, notamment la stœchiométrie de la réaction, la concentration et la pureté des réactifs ainsi que les conditions de réaction. La stœchiométrie de la réaction peut être déterminée à partir de l’équation chimique de la réduction du camphre en isobornéol à l’aide de tétrahydroborate de sodium :
C10H16O + 4 NaBH4 → C10H18O + 4 NaBO2 + 4 H2
D’après l’équation, une mole de camphre réagit avec 4 moles de tétrahydroborate de sodium. La quantité réelle de camphre qui réagira avec une quantité donnée de NaBH4 dépendra de la concentration et de la pureté des réactifs, ainsi que des conditions de réaction telles que la température, la durée et le catalyseur.
Par conséquent, sans informations plus précises, il n’est pas possible de déterminer le nombre exact de moles de camphre qui réagiront avec le tétrahydroborate de sodium.
