Le borate de sodium est un composé utilisé dans diverses industries. Il a de multiples applications, comme agent de nettoyage, flux en métallurgie et composant dans les cosmétiques et les détergents.
| Nom UICPA | Borate de sodium |
| Formule moléculaire | Na2B4O7 |
| Numero CAS | 1330-96-4 |
| Synonymes | Borax, tétraborate de sodium, tétraborate disodique, biborate de sodium |
| InChI | InChI=1S/B4O7.2Na/c5-1-7-3-9-2-8-4-10-3;;/q-2;2*+1 |
Propriétés du borate de sodium
Formule de borate de sodium
La formule chimique du borate de sodium est Na2B4H20O17. Il se compose de deux atomes de sodium (Na), de quatre atomes de bore (B) et de sept atomes d’oxygène (O). La formule représente le rapport de chaque élément du composé.
Borate De Sodium Masse molaire
La masse molaire du borax est calculée en additionnant les masses atomiques de tous les atomes du composé. La masse molaire du borax est d’environ 381,37 grammes par mole (g/mol). Il est utile pour déterminer la quantité de substance présente dans un échantillon donné.
Point d’ébullition du borate de sodium
Le borax a un point d’ébullition relativement élevé. À pression atmosphérique standard, il bout à environ 1 575 degrés Celsius (C). Ce point d’ébullition élevé le rend adapté à diverses applications industrielles impliquant des processus à haute température.
Borate de sodium Point de fusion
Le borax a un point de fusion d’environ 741 degrés Celsius (C). Il subit une transition de phase de l’état solide à l’état liquide à cette température. Le point de fusion relativement bas permet au borax de fondre facilement et d’être utilisé dans divers processus de fabrication.
Densité du borate de sodium g/ml
La densité du borax est d’environ 1,73 grammes par millilitre (g/mL). La densité est une mesure de la quantité de masse contenue dans un volume donné. La densité relativement élevée du borax en fait un composé utile dans les applications où son poids ou sa concentration est important.
Borate De Sodium Poids moléculaire
Le poids moléculaire du borax est d’environ 381,37 grammes par mole (g/mol). Il représente la somme des poids atomiques de tous les atomes d’une molécule de borax. Le poids moléculaire est essentiel pour divers calculs, comme la détermination du nombre de moles ou de la masse d’une substance.
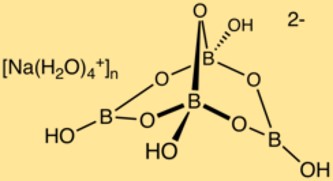
Structure du borate de sodium
Le borax a une structure cristalline complexe composée de polyèdres bore-oxygène et d’ions sodium. Les atomes de bore forment un réseau avec les atomes d’oxygène, créant ainsi une structure tridimensionnelle. Les ions sodium sont situés dans cette structure, assurant la stabilité du composé.
Solubilité du borate de sodium
Le borax est modérément soluble dans l’eau. Il se dissout facilement dans l’eau chaude et sa solubilité augmente avec la température. Cependant, sa solubilité dans les solvants organiques est limitée. La solubilité du borax le rend utile pour diverses applications, notamment comme agent de nettoyage et dans la formulation de solutions et de mélanges.
| Apparence | Poudre cristalline blanche |
| Gravité spécifique | 1,73 g/ml |
| Couleur | Blanc |
| Odeur | Inodore |
| Masse molaire | 381,37 g/mole |
| Densité | 1,73 g/ml |
| Point de fusion | 741 °C |
| Point d’ébullition | 1575 °C |
| Point d’éclair | N’est pas applicable |
| Solubilité dans l’eau | Soluble |
| Solubilité | Soluble dans l’eau, solubilité limitée dans les solvants organiques |
| Pression de vapeur | Pas disponible |
| Densité de vapeur | Pas disponible |
| pKa | N’est pas applicable |
| pH | Environ 9h-10h |
Sécurité et dangers du borate de sodium
Le borax doit être manipulé avec prudence en raison de ses risques potentiels pour la sécurité. Il peut provoquer une irritation de la peau, des yeux et du système respiratoire par contact direct ou par inhalation. L’ingestion de grandes quantités peut entraîner des troubles gastro-intestinaux. Des mesures de protection, telles que des gants et des lunettes, doivent être utilisées lorsque vous travaillez avec du borax pour éviter toute exposition. Il est important de le stocker dans un endroit sécurisé et bien aéré, à l’écart des substances incompatibles. En cas d’ingestion ou d’exposition accidentelle, des soins médicaux immédiats doivent être recherchés. Les fiches de données de sécurité et les directives de manipulation appropriées doivent être consultées pour obtenir des informations détaillées sur les dangers du borax et les précautions de sécurité.
| Symboles de danger | Toxique |
| Description de la sécurité | Nocif en cas d’ingestion. Provoque une irritation de la peau et des yeux. |
| Numéros d’identification de l’ONU | ONU 1458 |
| Code SH | 2840.19.20 |
| Classe de danger | 6.1 (Substances toxiques) |
| Groupe d’emballage | III |
| Toxicité | Toxicité modérée par ingestion ou contact cutané/yeux. |
Méthodes de synthèse du borate de sodium
Il existe plusieurs méthodes pour synthétiser le borax. Une méthode courante est la réaction entre le borax (tétraborate de sodium décahydraté) et le carbonate de sodium . Dans ce processus, dissolvez le borax dans l’eau, puis ajoutez du carbonate de sodium à la solution. La réaction se produit, formant du borax et précipitant un solide. Séparez et séchez le solide pour obtenir du borax.
Une autre méthode consiste à dissoudre l’acide borique dans l’eau et à ajouter progressivement de l’hydroxyde de sodium à la solution. La réaction se produit et forme du borax. Évaporez la solution pour éliminer l’excès d’eau et obtenir des cristaux de borax.
De plus, mélangez l’oxyde de bore avec l’hydroxyde de sodium dans un solvant approprié et chauffez le mélange. La réaction se produit et forme du borax. Filtrez le mélange pour séparer les impuretés et laissez le filtrat refroidir et cristalliser, donnant du borax.
Ces méthodes de synthèse fournissent des voies permettant d’obtenir du borax de manière contrôlée. Cependant, il est important de suivre les précautions de sécurité appropriées et de manipuler les produits chimiques de manière responsable pendant le processus de synthèse.
Utilisations du borate de sodium
Le borax, également connu sous le nom de borax, a un large éventail d’utilisations dans diverses industries en raison de ses propriétés polyvalentes. Voici quelques-unes de ses applications courantes :
- Flux en métallurgie : Il sert de flux dans les applications de soudage et de brasage, aidant à réduire le point de fusion des métaux et facilitant l’écoulement du métal en fusion.
- Ignifuge : Il trouve une application comme ignifuge dans divers matériaux, notamment les isolants cellulosiques, les textiles et les produits en bois.
- Verre et céramique : Le borax est un composant essentiel dans la fabrication du verre et de la céramique. Il aide à abaisser le point de fusion, à améliorer la durabilité et à améliorer les propriétés optiques de ces matériaux.
- Tampon pH : Il fonctionne comme un tampon pH dans les laboratoires et les expériences scientifiques.
- Agent de nettoyage : Les produits ménagers tels que les détergents à lessive, les savons à vaisselle et les nettoyants polyvalents utilisent efficacement le borax comme agent de nettoyage.
- Cosmétiques : les cosmétiques et les produits de soins personnels utilisent le borax comme agent tampon, ajusteur de pH et émulsifiant.
- Agent de conservation : Les produits en bois contiennent du borax comme agent de conservation pour prévenir les infestations de champignons et d’insectes.
- Agriculture : Le borax agit comme un engrais en micronutriments pour corriger les carences en bore dans les cultures, favorisant ainsi une croissance saine des plantes.
- Applications médicales : Les formulations médicinales incorporent du borax pour ses propriétés antiseptiques et astringentes.
- Traitement de l’eau : Les procédés de traitement de l’eau utilisent du borax pour inhiber la croissance des algues et contrôler les niveaux de pH.
Ces diverses applications mettent en évidence l’importance du borax dans diverses industries, ce qui en fait un composé précieux et polyvalent.
Des questions:
Q : À quoi sert le borate de sodium ?
R : Le borax est utilisé comme agent de nettoyage, fondant en métallurgie, composant dans les cosmétiques, ignifuge, dans la fabrication de verre/céramique, comme agent de préservation du bois, etc.
Q : Où acheter du borate de sodium ?
R : Le borax peut être acheté auprès de divers fournisseurs de produits chimiques, quincailleries, marchés en ligne et certaines épiceries.
Q : Quel sera le cation lorsque le borate de sodium se dissoudra ?
R : Le cation libéré lors de la dissolution du borax est le sodium (Na+).
Q : Le borate de sodium est-il identique à l’acide borique ?
R : Non, le borax et l’acide borique sont des composés différents, bien qu’ils contiennent tous deux du bore.
Q : Le borate de sodium est-il identique au borax ?
R : Oui, le borax est communément appelé borax.
Q : Le borate de sodium est-il une base ?
R : Le borax agit comme une base faible dans les solutions aqueuses.
Q : Le borate de sodium est-il potable ?
R : Le borax ne doit pas être ingéré, car il peut être toxique. Ce n’est pas destiné à la consommation.
Q : Le borate de sodium neutralise-t-il l’acide sulfurique ?
R : Non, le borax ne neutralise pas l’acide sulfurique. Il peut réagir mais ne le neutralisera pas complètement.
Q : Quelle est la fonction du borate de sodium dans le tampon d’élution pH 10 ?
R : Le borax dans le tampon d’élution pH 10 facilite l’élution des biomolécules chargées négativement des colonnes de chromatographie.
Q : Qu’est-ce que le borax ?
R : Le borax, également connu sous le nom de borate de sodium, est un composé minéral naturel composé de molécules de sodium, de bore, d’oxygène et d’eau.
Q : Que se passe-t-il lorsque le borax est fortement chauffé ?
R : Lorsque le borax est fortement chauffé, il subit une déshydratation et perd ses molécules d’eau, entraînant la formation de borax anhydre.
Q : Le borax est-il la même chose que l’acide borique ?
R : Non, le borax et l’acide borique sont des composés différents. Le borax est du borate de sodium, tandis que l’acide borique est une forme acide du bore.
Q : Qu’est-ce que la poudre de borax ?
R : La poudre de borax fait référence à la forme en poudre du borax, qui est utilisée à diverses fins telles que le nettoyage, la lessive et l’artisanat.
