Le bleu de bromothymol (BTB) est un indicateur de pH qui change de couleur du jaune au bleu en présence d’une solution basique. Il est couramment utilisé dans les expériences scientifiques et comme outil de diagnostic médical.
| Nom UICPA | 3′,3”-dibromothymolsulfonphtaléine |
| Formule moléculaire | C27H28Br2O5S |
| Numero CAS | 76-59-5 |
| Synonymes | bromothymol sulfonphtaléine; 4,4′-(1,1-dioxido-3H-2,1-benzoxathiole-3,3-diyl)bis(2-bromo-3-méthyl-6-(1-méthyléthyl)phénol) |
| InChI | InChI=1S/C27H28Br2O5S/c1-13(2)17-11-20(15(5)23(28)18(17)7-9-19(24(20)29)8-10-21(27) 22(30)12-25(31)32)37(33,34)36-26-14(3)6-4-16(35-26)24-7-9-29-11-10-23( 24)28/h4-7,9-12,31-32H,8H2,1-3H3 |
Bleu De Bromothymol Masse molaire
Le BTB a une masse molaire de 624,38 g/mol. La masse molaire est la masse d’une mole d’une substance et elle est couramment utilisée dans les calculs impliquant des réactions chimiques. La masse molaire du BTB est calculée en additionnant les poids atomiques de tous les atomes de sa formule chimique, qui est C27H28Br2O5S. Connaître la masse molaire d’une substance est important pour déterminer la quantité de substance nécessaire pour une réaction donnée, ainsi que pour déterminer la quantité de produit produit dans une réaction.
Point d’ébullition du bleu de bromothymol
Le BTB a un point d’ébullition de 636,3°C à 760 mmHg. Le point d’ébullition est la température à laquelle une substance passe de son état liquide à son état gazeux à une pression donnée. Le point d’ébullition élevé du BTB indique qu’il s’agit d’un composé stable qui ne se vaporise pas ou ne se décompose pas facilement dans des conditions normales. Le point d’ébullition d’une substance peut être utilisé pour déterminer sa pureté, car les impuretés peuvent modifier le point d’ébullition.
Bleu de bromothymol Point de fusion
Le BTB a un point de fusion de 165-170°C. Le point de fusion est la température à laquelle une substance solide passe de son état solide à son état liquide. Le point de fusion d’une substance est utilisé pour l’identifier et la caractériser, car différentes substances ont des points de fusion différents. Le point de fusion du BTB est relativement élevé, ce qui indique qu’il s’agit d’un composé stable qui ne se décompose pas facilement.
Bleu de bromothymol Densité g/ml
Le BTB a une densité de 1,36 g/mL. La densité est la masse d’une substance par unité de volume et mesure le degré de densité des molécules dans une substance. La densité du BTB indique qu’il s’agit d’un composé relativement dense et qu’il est couramment utilisé comme étalon dans les mesures de densité.
Bleu De Bromothymol Poids moléculaire
Le poids moléculaire du BTB est de 624,38 g/mol. Le poids moléculaire est la somme des poids atomiques de tous les atomes d’une molécule et constitue un facteur important dans les réactions chimiques. Le poids moléculaire du BTB est utilisé pour déterminer la quantité de substance nécessaire pour une réaction donnée, ainsi que pour déterminer la quantité de produit produit dans une réaction.
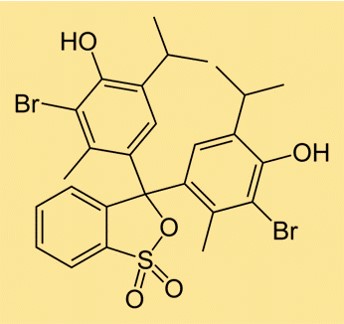
Structure du bleu de bromothymol
La structure du BTB est composée de deux cycles aromatiques auxquels est attaché chacun un atome de brome. Il existe également un groupe sulfonate attaché à l’un des anneaux, ce qui rend la molécule soluble dans l’eau. La structure du BTB est similaire à celle d’autres indicateurs de pH, utilisés pour déterminer l’acidité ou la basicité d’une solution.
Formule de bleu de bromothymol
La formule chimique du BTB est C27H28Br2O5S. La formule indique le nombre et les types d’atomes dans la molécule et est utilisée dans les réactions chimiques pour déterminer la quantité de substance nécessaire pour une réaction donnée. La formule du BTB montre qu’il contient deux atomes de brome, qui lui confèrent sa couleur jaune-vert distinctive dans les solutions acides, et un groupe sulfonate, qui le rend soluble dans l’eau.
| Apparence | Poudre vert foncé |
| Gravité spécifique | 1,36 |
| Couleur | Vert jaunâtre |
| Odeur | Inodore |
| Masse molaire | 624,38 g/mole |
| Densité | 1,36 g/ml |
| Point de fusion | 165-170°C |
| Point d’ébullition | 636,3°C à 760 mmHg |
| Point d’éclair | N’est pas applicable |
| Solubilité dans l’eau | Soluble |
| Solubilité | Soluble dans l’éthanol, légèrement soluble dans l’éther et le chloroforme |
| Pression de vapeur | N’est pas applicable |
| Densité de vapeur | N’est pas applicable |
| pKa | 6.3 |
| pH | Jaune à pH 6,0, vert à pH 7,6, bleu à pH 7,9 |
Sécurité et dangers du bleu de bromothymol
Le BTB peut être nocif s’il est ingéré, inhalé ou absorbé par la peau. Cela peut provoquer une irritation des yeux, de la peau et du système respiratoire. L’ingestion peut provoquer une irritation gastro-intestinale, des nausées, des vomissements et des douleurs abdominales. L’inhalation de poussières ou de vapeurs de BTB peut provoquer une irritation respiratoire, de la toux et des difficultés respiratoires. La substance peut également être nocive pour la vie aquatique et ne doit pas être éliminée dans les sources d’eau. Un équipement de protection individuelle approprié, tel que des gants et des lunettes de protection, doit être porté lors de la manipulation du BTB, et il doit être utilisé et éliminé conformément aux procédures et réglementations de laboratoire appropriées.
| Symboles de danger | Aucun |
| Description de la sécurité | S22 : Ne respirez pas la poussière. S24/25 : Éviter le contact avec la peau et les yeux. S36/37/39 : Porter des vêtements de protection appropriés, des gants et un équipement de protection des yeux/du visage. |
| Identifiants ONU | Non réglementé |
| Code SH | 2921.59.90 |
| Classe de danger | Non classés |
| Groupe d’emballage | N’est pas applicable |
| Toxicité | DL50 (orale, rat) = 4 500 mg/kg |
Méthodes de synthèse du bleu de bromothymol
Il existe différentes méthodes pour synthétiser le BTB.
Une méthode courante est la réaction entre le bleu de thymol et le brome en présence d’un catalyseur acide fort, tel que l’acide chlorhydrique. La réaction se déroule par addition électrophile de brome à la molécule de bleu de thymol, suivie de la substitution d’un atome d’hydrogène par un atome de brome. Le composé résultant est le BTB.
Une autre méthode implique la réaction entre le 2,6-dibromoindophénol et le rouge de crésol en présence d’un catalyseur acide fort. La réaction se déroule par substitution électrophile d’un atome d’hydrogène dans la molécule de rouge de crésol par un atome de brome de la molécule de 2,6-dibromoindophénol. Le composé résultant est le BTB.
Une troisième méthode implique la réaction entre le bleu de thymol et le bromure de sodium en présence d’hydroxyde de sodium. La réaction se déroule par la substitution d’un atome d’hydrogène dans la molécule de bleu de thymol par un atome de brome provenant de la molécule de bromure de sodium. Le composé résultant est le BTB.
Quelle que soit la méthode utilisée, le produit résultant doit être purifié par recristallisation ou chromatographie sur colonne pour obtenir du BTB pur.
Utilisations du bleu de bromothymol
BTB a plusieurs applications dans des domaines variés. Certaines des utilisations du BTB comprennent :
- Indicateur : Utilisé comme indicateur acido-basique, avec une plage de pH comprise entre 6,0 et 7,6. À pH 6,0, il est jaune, à pH 7,6, il est vert et à pH 7,9, il est bleu.
- Expériences en laboratoire : utilisé dans diverses expériences en laboratoire pour tester la présence de dioxyde de carbone et d’autres gaz et pour déterminer le quotient respiratoire.
- Aquaculture : Utilisé en aquaculture pour surveiller les niveaux de pH de l’eau dans les aquariums et les étangs.
- Domaine médical : Utilisé pour tester la présence de bile dans des échantillons d’urine et pour détecter la présence d’infections fongiques.
- Éducation : utilisé dans l’éducation comme aide visuelle pour démontrer les principes des réactions acido-basiques et pour enseigner aux élèves les niveaux de pH.
- Industrie agricole : utilisée pour mesurer les niveaux de pH du sol, facteur important pour déterminer la santé et la croissance des plantes.
- Tests environnementaux : utilisé dans les tests environnementaux pour mesurer les niveaux de pH des sources d’eau, telles que les lacs et les rivières, afin de garantir leur adéquation à la vie aquatique.
Dans l’ensemble, le BTB est un composé polyvalent avec de nombreuses applications dans divers domaines.
Des questions:
Q : Qu’est-ce que le bleu de bromothymol ?
R : Le BTB est un indicateur de pH couramment utilisé dans les expériences en laboratoire et dans diverses autres applications. C’est un composé chimique qui change de couleur en fonction de l’acidité ou de l’alcalinité d’une solution.
Q : Quelle est la plage de pH du bleu de bromothymol ?
R : La plage de pH du BTB se situe entre 6,0 et 7,6. À pH 6,0, il est jaune, à pH 7,6, il est vert et à pH 7,9, il est bleu.
Q : Quel est le changement de couleur du bleu de bromothymol ?
R : Le changement de couleur du BTB dépend du pH de la solution. À pH 6,0, il est jaune, à pH 7,6, il est vert et à pH 7,9, il est bleu.
Q : Le bleu de bromothymol est-il un acide ou une base ? R : Le BTB n’est ni un acide ni une base. C’est un indicateur qui change de couleur en fonction de l’acidité ou de l’alcalinité d’une solution.
