Le bisulfite de potassium est un composé chimique. Il a la formule KHSO3. Il agit comme conservateur et antioxydant dans les aliments et le vin.
| Nom de l’UICPA | Hydrogénosulfite de potassium |
| Formule moléculaire | KHSO3 |
| Numero CAS | 7773-03-7 |
| Synonymes | Bisulfite de potassium, bisulfite de potassium, sel monopotassique, sulfite monopotassique, hydrosulfite de potassium |
| InChI | InChI=1S/K.H2O3S/c;1-4(2)3/h;(H2,1,2,3)/q+1;/p-1 |
Propriétés du bisulfite de potassium
Formule de bisulfite de potassium
La formule du bisulfite de potassium est KHSO3. Cette formule montre le rapport des atomes de potassium, d’hydrogène, de soufre et d’oxygène dans une unité de bisulfite de potassium. La formule peut également s’écrire KH(SO3), ce qui montre que le bisulfite de potassium est un sel de potassium et d’acide sulfureux (H2SO3).
Bisulfite De Potassium Masse molaire
La masse molaire du bisulfite de potassium est de 120,1694 g/mol. Cela signifie qu’une mole de bisulfite de potassium a une masse de 120,1694 grammes. La masse molaire est calculée en additionnant les masses atomiques de potassium, d’hydrogène, de soufre et d’oxygène dans la formule KHSO3.
Point d’ébullition du bisulfite de potassium
KHSO3 n’a pas de point d’ébullition défini car il se décompose avant d’atteindre le point d’ébullition. Lorsqu’il est chauffé au-dessus de 190 °C, le KHSO3 se décompose en métabisulfite de potassium et en eau. La réaction de décomposition est endothermique, c’est-à-dire qu’elle absorbe la chaleur de l’environnement.
Bisulfite de Potassium Point de fusion
Le KHSO3 a un point de fusion de 190 °C, soit la même température à laquelle il se décompose. Par conséquent, KHSO3 n’existe pas sous forme liquide dans des conditions normales. C’est un solide cristallin blanc qui se dissout dans l’eau.
Bisulfite de potassium Densité g/ml
La densité de KHSO3 est de 2,103 g/ml à 20 °C. Cela signifie qu’un millilitre de KHSO3 a une masse de 2,103 grammes. La densité est influencée par la température et la concentration de la solution.
Bisulfite De Potassium Poids moléculaire
Le poids moléculaire du KHSO3 est le même que sa masse molaire, qui est de 120,1694 g/mol. Le poids moléculaire est la masse d’une molécule de KHSO3, qui est très petite et ne peut être mesurée directement. Le poids moléculaire est utile pour calculer le nombre de molécules dans une masse ou un volume donné d’une substance.
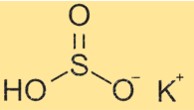
Structure du bisulfite de potassium
KHSO3 a une structure composée d’ions K+ et HSO3-. L’ion bisulfite a une forme tétraédrique avec un atome d’hydrogène et trois atomes d’oxygène liés à un atome de soufre central. L’atome de soufre possède une double liaison avec un atome d’oxygène et une simple liaison avec les deux autres atomes d’oxygène. L’atome d’hydrogène est attaché à l’un des atomes d’oxygène à liaison simple.
Solubilité du bisulfite de potassium
KHSO3 est un mélange chimique qui se dissout dans l’eau pour former des ions potassium et des ions bisulfite. Il a une odeur sulfureuse et un aspect solide blanc. Il est soluble dans l’eau, avec une solubilité de 49 g/100 mL à 20 °C. Il est utilisé comme agent stérilisant dans la production de boissons alcoolisées.
| Apparence | Poudre cristalline blanche |
| Densité spécifique | 2.103 |
| Couleur | Blanc |
| Odeur | de type SO2 |
| Masse molaire | 120,1694 g/mole |
| Densité | 2,103 g/ml à 20 °C |
| Point de fusion | 190 °C (se décompose) |
| Point d’ébullition | N/A (se décompose) |
| Point d’éclair | N / A |
| Solubilité dans l’eau | 49 g/100 mL à 20 °C |
| Solubilité | Insoluble dans l’alcool |
| Pression de vapeur | N / A |
| Densité de vapeur | N / A |
| pKa | 6,97 à 25 °C |
| pH | 4,5 (solution 0,1M) |
Sécurité et dangers du bisulfite de potassium
Le KHSO3 est une substance corrosive qui peut provoquer de graves brûlures cutanées et des lésions oculaires. Il peut également provoquer une irritation des voies respiratoires et des brûlures du tube digestif en cas d’inhalation ou d’ingestion. Il est sensible à l’humidité et libère du dioxyde de soufre toxique lorsqu’il réagit avec les acides. Il doit être manipulé avec précaution et avec un équipement de protection individuelle approprié. Il doit être stocké dans un endroit sec et bien ventilé, à l’abri de la chaleur, des étincelles, des flammes et des matières incompatibles. Il doit être éliminé conformément aux réglementations locales. En cas d’exposition, consultez immédiatement un médecin et suivez les mesures de premiers secours indiquées sur la fiche de données de sécurité.
| Symboles de danger | C (corrosif) |
| Description de la sécurité | S26 : En cas de contact avec les yeux, rincer immédiatement et abondamment à l’eau et consulter un médecin. S36/37/39 : Porter des vêtements de protection appropriés, des gants et un équipement de protection des yeux/du visage. S45 : En cas d’accident ou de malaise, consulter immédiatement un médecin (si possible lui montrer l’étiquette). |
| Numéros d’identification de l’ONU | ONU 3260 |
| Code HS | 2832 10 00 |
| Classe de danger | 8 |
| Groupe d’emballage | II |
| Toxicité | DL50 orale (rat): 2340 mg/kg |
Méthodes de synthèse du bisulfite de potassium
Voici quelques méthodes pour synthétiser KHSO3 :
- Une méthode consiste à réagir avec du dioxyde de soufre et du carbonate de potassium dans une solution. Pour obtenir des cristaux de KHSO3, faites passer du dioxyde de soufre à travers la solution jusqu’à ce qu’il cesse de dégager du dioxyde de carbone, puis concentrez la solution.
- Une autre méthode consiste à réagir avec du chlorure de potassium et de l’acide sulfurique dans une solution. La réaction produit du chlorure d’hydrogène et du KHSO3. Après refroidissement, la solution subit activement une filtration pour séparer le solide KHSO3.
- Une troisième méthode consiste à réagir avec l’hydroxyde de potassium et l’acide sulfurique dans une solution. La réaction produit de l’eau et du KHSO3. Pour purifier le KHSO3, on peut recristalliser la solution.
Utilisations du bisulfite de potassium
Voici quelques utilisations de KHSO3 :
- Agent stérilisant : utilisé comme agent stérilisant dans la production de boissons alcoolisées. Il empêche la croissance de bactéries et de champignons susceptibles d’altérer le vin ou la bière.
- Conservateur : Utilisé comme conservateur et antioxydant dans les aliments. Il inhibe le brunissement et l’oxydation des fruits, légumes, jus, sauces et aliments séchés.
- Agent réducteur : Utilisé comme agent réducteur en chimie organique. Il peut réduire les aldéhydes, les cétones, les groupes nitro, les sulfones et les sulfoxydes en leurs alcools, amines, sulfures et sulfures correspondants.
- Agent de blanchiment : Utilisé comme agent de blanchiment dans les industries textiles et papetières. Il peut éliminer la couleur et les taches des tissus et de la pulpe.
- Utilisé comme source de dioxyde de soufre dans diverses applications. Il peut libérer du dioxyde de soufre lorsqu’il est chauffé ou mélangé à des acides. Le dioxyde de soufre est un fumigant, un désinfectant, un solvant et un catalyseur.
Des questions:
Q : Quelle quantité de bisulfite de potassium faut-il désinfecter ?
R : La quantité de KHSO3 nécessaire à la désinfection dépend de la concentration de la solution et des micro-organismes spécifiques ciblés. Il est recommandé de suivre les instructions figurant sur l’étiquette du produit ou de demander conseil à un professionnel qualifié.
Q : Quelle est la formule du bisulfite de potassium ?
R : La formule chimique du bisulfite de potassium est KHSO3.
Q : Le bisulfite de potassium est-il sans danger ?
R : KHSO3 est généralement sans danger lorsqu’il est utilisé conformément aux instructions. Cependant, il peut être irritant pour la peau, les yeux et le système respiratoire. Cela peut également provoquer des réactions allergiques chez certaines personnes. Il est important de manipuler et de stocker KHSO3 correctement et d’utiliser un équipement de protection si nécessaire.
Q : Combien de temps le bisulfite de potassium est-il bon ?
R : La durée de conservation du KHSO3 dépend de divers facteurs tels que les conditions de stockage, la concentration et la pureté du produit. Généralement, il peut durer plusieurs années s’il est conservé dans un endroit frais et sec dans un récipient hermétiquement fermé.
Q : Comment le NaHSO3 et l’iodate de potassium réagissent-ils pour produire une réaction de l’iode avec les équations de l’amidon ?
R : La réaction du NaHSO3 et de l’iodate de potassium produit de l’iode, qui peut ensuite réagir avec l’amidon pour former un complexe bleu-noir. Les équations des réactions sont : 5NaHSO3 + KIO3 → 5NaHSO4 + KI + 3H2O + I2 I2 + amidon → complexe bleu-noir
