Le bisulfite de calcium (Ca(HSO3)2) est un composé composé de calcium, de soufre et d’oxygène. Il est couramment utilisé comme conservateur alimentaire et antioxydant dans l’industrie alimentaire.
| Nom UICPA | Hydrogénosulfite de calcium |
| Formule moléculaire | Ca(HSO3)2 |
| Numero CAS | 13780-03-5 |
| Synonymes | Bisulfite de calcium, Hydrogénosulfite de calcium, Acide sulfureux de calcium, Bisulfite de chaux |
| InChI | InChI=1S/Ca.2H2O3S/c;2*1-4(2)3/h;(H2,1,2,3)/q+2;;/p-2 |
Propriétés du bisulfite de calcium
Formule de bisulfite de calcium
La formule chimique du bisulfite de calcium est Ca(HSO3)2. Il indique le nombre et le type d’atomes dans une molécule ou une unité de formule. La formule est importante pour déterminer le poids moléculaire, la masse molaire et d’autres propriétés du composé. Le Ca(HSO3)2 est un composé important utilisé dans l’industrie alimentaire comme conservateur et antioxydant.
Bisulfite De Calcium Masse molaire
Ca(HSO3)2 a une masse molaire de 202,2 g/mol. C’est un composé ionique composé de calcium, d’hydrogène sulfite et de dioxyde de soufre. La masse molaire est importante pour calculer la quantité de Ca(HSO3)2 nécessaire dans une réaction ou pour préparer une solution d’une concentration souhaitée.
Point d’ébullition du bisulfite de calcium
Le point d’ébullition du Ca(HSO3)2 n’est pas une valeur bien définie car il se décompose avant d’atteindre son point d’ébullition. Le Ca(HSO3)2 se décompose en libérant du dioxyde de soufre. Par conséquent, il n’est pas utilisé dans les processus nécessitant des applications à haute température.
Bisulfite de calcium Point de fusion
Le point de fusion du Ca(HSO3)2 est de 203°C. A cette température, il se décompose pour former du sulfate de calcium et du dioxyde de soufre. La décomposition du Ca(HSO3)2 est une réaction exothermique et produit une grande quantité de chaleur. Il faut donc le manipuler avec précaution lorsqu’il est chauffé.
Densité du bisulfite de calcium g/mL
La densité du Ca(HSO3)2 varie en fonction de la forme sous laquelle il se trouve. La forme anhydre du Ca(HSO3)2 a une densité de 2,68 g/mL, tandis que la forme dihydratée a une densité de 1,98 g/mL. La densité d’une substance est importante pour déterminer la quantité de substance nécessaire pour remplir un certain volume.
Bisulfite De Calcium Poids moléculaire
Le poids moléculaire de Ca(HSO3)2 est de 202,2 g/mol. Il est calculé en additionnant les poids atomiques des éléments constitutifs : calcium (40,08 g/mol), hydrogène (1,008 g/mol), soufre (32,06 g/mol) et oxygène (15,99 g/mol). Le poids moléculaire est important pour déterminer la quantité de substance nécessaire à une réaction.
Structure du bisulfite de calcium
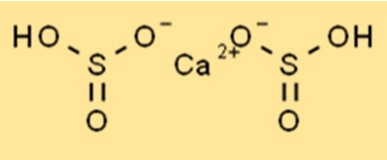
La structure de Ca(HSO3)2 est un composé ionique de formule chimique Ca(HSO3)2. Il a une forme tétraédrique avec un atome central de calcium entouré de quatre atomes d’oxygène. Les ions sulfite d’hydrogène sont liés à l’atome de calcium par des liaisons ioniques. La structure du Ca(HSO3)2 est importante pour comprendre ses propriétés chimiques.
Solubilité du bisulfite de calcium
Le Ca(HSO3)2 est modérément soluble dans l’eau, avec une solubilité d’environ 60 grammes pour 100 millilitres d’eau à température ambiante. Sa solubilité augmente avec la température et il est également soluble dans l’éthanol et le glycérol.
| Apparence | Poudre cristalline blanche |
| Gravité spécifique | 2,68 (anhydre), 1,98 (dihydraté) |
| Couleur | Blanc |
| Odeur | Inodore |
| Masse molaire | 202,2 g/mole |
| Densité | 2,68 g/mL (anhydre), 1,98 g/mL (dihydraté) |
| Point de fusion | 203°C |
| Point d’ébullition | Se décompose |
| Point d’éclair | N’est pas applicable |
| Solubilité dans l’eau | Soluble |
| Solubilité | Soluble dans l’eau, insoluble dans les solvants organiques |
| La pression de vapeur | N’est pas applicable |
| Densité de vapeur | N’est pas applicable |
| pKa | 1,92 |
| pH | 4,5-6,0 |
Sécurité et dangers du bisulfite de calcium
Le Ca(HSO3)2 est généralement considéré comme sûr lorsqu’il est utilisé en petites quantités dans les produits alimentaires. Cependant, cela peut être dangereux s’il n’est pas manipulé correctement. Il peut provoquer une irritation de la peau, des yeux et des problèmes respiratoires s’il est inhalé. L’ingestion de grandes quantités peut provoquer des troubles gastro-intestinaux, notamment des nausées et des vomissements. Le Ca(HSO3)2 doit être manipulé avec précaution et des équipements de protection, tels que des gants et un respirateur, doivent être portés lorsque vous travaillez avec. Il doit être stocké dans un endroit frais et sec, à l’abri de la chaleur et des matières incompatibles. Les déversements doivent être nettoyés immédiatement pour éviter toute exposition à la substance.
| Symboles de danger | Aucun |
| Description de la sécurité | Éviter l’inhalation, l’ingestion et le contact peau/yeux. Portez un équipement de protection. |
| Numéros d’identification de l’ONU | Non réglementé |
| Code SH | 28321000 |
| Classe de danger | Non classés |
| Groupe d’emballage | N’est pas applicable |
| Toxicité | Faible toxicité, mais peut provoquer une irritation de la peau et des yeux, des problèmes respiratoires et des troubles gastro-intestinaux en cas d’ingestion en grande quantité. |
Méthodes de synthèse du bisulfite de calcium
Plusieurs méthodes permettent de synthétiser du Ca(HSO3)2.
Une méthode consiste à faire réagir du dioxyde de soufre gazeux avec de l’hydroxyde de calcium , ce qui produit du Ca(HSO3)2 et de l’eau.
Le procédé consiste à faire réagir de l’oxyde de calcium avec du dioxyde de soufre gazeux, générant du sulfite de calcium. Ensuite, la réaction du dioxyde de soufre gazeux avec le sulfite de calcium produit du Ca(HSO3)2.
La réaction du dioxyde de soufre gazeux avec de l’eau et du carbonate de calcium produit du Ca(HSO3)2, du dioxyde de carbone gazeux et de l’eau.
Pour synthétiser du Ca(HSO3)2 en laboratoire, on peut ajouter du dioxyde de soufre gazeux à une solution d’ hydroxyde de calcium ou d’oxyde de calcium jusqu’à ce que le pH souhaité soit atteint. La solution résultante contiendra du Ca(HSO3)2, qui peut être purifié par des méthodes de filtration ou de précipitation.
Utilisations du bisulfite de calcium
Le Ca(HSO3)2 a plusieurs utilisations dans diverses industries en raison de ses propriétés uniques. Voici quelques-unes des utilisations les plus courantes du Ca(HSO3)2 :
- Industrie alimentaire : Utilisé comme conservateur alimentaire pour empêcher la croissance de bactéries et d’autres micro-organismes dans les produits alimentaires, notamment dans les fruits et légumes.
- Traitement de l’eau : utilisé dans le traitement de l’eau pour éliminer l’excès de chlore et d’autres produits chimiques de l’eau et pour empêcher la croissance de bactéries et d’algues dans les systèmes d’eau.
- Industrie textile : Utilisé dans l’industrie textile pour éliminer l’excès de colorant du tissu et éviter la décoloration pendant le processus de teinture.
- Industrie du papier : Utilisé dans l’industrie du papier pour blanchir la pâte et prévenir la décoloration des produits en papier.
- Industrie chimique : Utilisé dans l’industrie chimique comme agent réducteur et comme source de dioxyde de soufre gazeux.
- Industrie pharmaceutique : Utilisé dans l’industrie pharmaceutique comme antioxydant et conservateur dans certains médicaments.
Des questions:
Q : L’Autorité européenne de sécurité des aliments approuve-t-elle le bisulfite de calcium ?
R : Oui, l’Autorité européenne de sécurité des aliments (EFSA) a approuvé l’utilisation du Ca(HSO3)2 comme additif alimentaire. Il est répertorié comme conservateur alimentaire approuvé dans l’Union européenne.
Q : Quel est l’indice E du bisulfite de calcium ?
R : Le nombre E de Ca(HSO3)2 est E227. Le numéro E est un code attribué aux additifs alimentaires par l’Union européenne.
Q : Le bisulfite de calcium est-il sans danger ?
R : Le Ca(HSO3)2 est généralement considéré comme sans danger pour la consommation en petites quantités. Cependant, il peut provoquer une irritation de la peau et des yeux, des problèmes respiratoires et des troubles gastro-intestinaux s’il est ingéré en grande quantité. Il est important de manipuler et de stocker correctement le Ca(HSO3)2 pour garantir sa sécurité.
Q : Quelle est la solubilité du bisulfite de calcium dans l’eau ?
R : Le Ca(HSO3)2 est modérément soluble dans l’eau, avec une solubilité d’environ 60 grammes pour 100 millilitres d’eau à température ambiante.
Q : Quelles sont les propriétés thermodynamiques du bisulfite de calcium ?
R : Les propriétés thermodynamiques du Ca(HSO3)2 incluent un point de fusion d’environ 150 °C et un point d’ébullition d’environ 160 °C. Sa capacité thermique et son enthalpie de formation ont également été étudiées dans diverses études de recherche.
