Le bifluorure d’ammonium (NH5F2) est un composé chimique. Il se dissout dans l’eau et forme de l’acide fluorhydrique. Il peut attaquer le verre et corroder les métaux.
| Nom de l’UICPA | Fluorure d’hydrogène et d’ammonium |
| Formule moléculaire | [NH4] [HF2] |
| Numero CAS | 1341-49-7 |
| Synonymes | Fluorure acide d’ammonium, fluorhydrate d’ammonium, difluorure d’ammonium, hydrogénodifluorure d’ammonium, difluorure d’hydrogène d’ammonium |
| InChI | InChI=1S/F2H.H3N/c1-3-2;/h;1H3/q-1;/p+1 |
Propriétés du bifluorure d’ammonium
Formule de bifluorure d’ammonium
La formule du bifluorure d’ammonium est [NH4] [HF2] ou [NH4]F·HF. Cela indique que le composé contient un cation ammonium ([NH4]+) et un anion bifluorure ou hydrogène (difluorure) ([HF2]−). La formule peut également s’écrire NH5F2, qui indique le nombre d’atomes de chaque élément du composé.
Bifluorure D’Ammonium Masse molaire
La masse molaire du difluorure d’ammonium est de 57,044 g/mol. Il est calculé en additionnant les masses atomiques des éléments dans la formule : (14,007 + 4 × 1,008) + (2 × 18,998) = 57,044 g/mol.
Point d’ébullition du bifluorure d’ammonium
Le point d’ébullition du difluorure d’ammonium est de 240 °C (464 °F ; 513 K). Cependant, le composé se décompose avant d’atteindre cette température, libérant des gaz d’ammoniac et de fluorure d’hydrogène 1 . Par conséquent, le difluorure d’ammonium n’a pas de véritable point d’ébullition.
Bifluorure d’ammonium Point de fusion
Le point de fusion du difluorure d’ammonium est de 126 °C (259 °F ; 399 K). C’est la température à laquelle le composé solide se transforme en liquide. Le point de fusion dépend de la force des forces intermoléculaires entre les molécules du composé.
Densité du bifluorure d’ammonium g/ml
La densité du difluorure d’ammonium est de 1,50 g/ml. C’est la masse du composé par unité de volume. La densité peut être mesurée en divisant la masse d’un échantillon par son volume. La densité d’une substance dépend de sa structure moléculaire et de son emballage.
Bifluorure D’Ammonium Poids moléculaire
Le poids moléculaire du difluorure d’ammonium est de 57,044 g/mol. C’est la même chose que la masse molaire du composé. Le poids moléculaire peut être utilisé pour calculer le nombre de moles d’une substance dans une masse ou un volume donné.
Structure du bifluorure d’ammonium
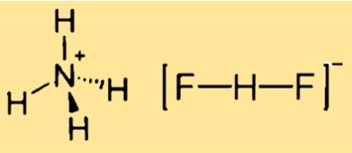
La structure du difluorure d’ammonium est cubique, liée à la structure CsCl. Cela signifie que le composé a un réseau cristallin avec une cellule unitaire cubique, où chaque cation ammonium est entouré de quatre centres fluorure dans un tétraèdre, et chaque anion difluorure est linéaire. La structure peut être représentée par un modèle tridimensionnel ou un diagramme bidimensionnel.
Solubilité du bifluorure d’ammonium
La solubilité du difluorure d’ammonium dans l’eau est de 63 g/100 ml à 20 °C. Cela signifie que 63 grammes du composé peuvent se dissoudre dans 100 millilitres d’eau à cette température. La solubilité dépend de la polarité et de la capacité de liaison hydrogène du composé et du solvant.
| Apparence | Cristaux incolores ou cristal blanc |
| Densité spécifique | 1,50 |
| Couleur | Incolore |
| Odeur | Légèrement piquant, piquant |
| Masse molaire | 57,044 g/mole |
| Densité | 1,50 g/cm3 |
| Point de fusion | 126 °C (259 °F; 399 K) |
| Point d’ébullition | 240 °C (464 °F; 513 K) (se décompose) |
| Point d’éclair | Ininflammable |
| Solubilité dans l’eau | 63 g/100 ml (20 °C) |
| Solubilité | Légèrement soluble dans l’alcool, insoluble dans l’ammoniaque liquide |
| Pression de vapeur | Pas disponible |
| Densité de vapeur | Pas disponible |
| pKa | Pas disponible |
| pH | Pas disponible |
Sécurité et dangers du bifluorure d’ammonium
Le difluorure d’ammonium est un produit chimique toxique et corrosif qui peut vous nuire si vous l’avalez, le respirez ou le touchez. Il peut provoquer de graves brûlures et lésions oculaires, des saignements de nez, de la toux, une respiration sifflante, un essoufflement, des nausées, des vomissements et une perte d’appétit. Il peut également libérer du fluorure d’hydrogène lorsqu’il est chauffé, ce qui est très dangereux à inhaler. Vous devez éviter tout contact avec ce produit chimique et porter des gants de protection, des vêtements, une protection des yeux et du visage lors de sa manipulation. Si vous y êtes exposé, vous devez rincer à l’eau et consulter immédiatement un médecin. Vous devez également laver tout vêtement contaminé avant de le réutiliser.
| Symboles de danger | T, C |
| Description de la sécurité | S26, S36/37/39, S45 |
| Numéros d’identification de l’ONU | UN 1727 (solide), UN 2817 (solution) |
| Code HS | 2826.19 |
| Classe de danger | 8 |
| Groupe d’emballage | II |
| Toxicité | DL50 orale (rat) = 200 mg/kg |
Méthodes de synthèse du bifluorure d’ammonium
Différentes méthodes permettent de préparer du difluorure d’ammonium, un sel inorganique. Certaines des méthodes courantes sont :
- Processus en phase vapeur : Cette méthode implique la réaction du gaz ammoniac et du fluorure d’hydrogène gazeux à des températures et une pression élevées. Le produit est une poudre de difluorure d’ammonium sèche et pure. Cependant, cette méthode nécessite un équipement complexe et des investissements élevés.
- Méthode en phase liquide : Cette méthode implique la réaction de solutions aqueuses d’ ammoniac et de fluorure d’hydrogène ou de fluorure d’ammonium et d’acide fluorhydrique à température et pression modérées. Le produit est un cristal de difluorure d’ammonium humide et moins pur. Les gens utilisent largement cette méthode car elle est simple, mais le produit est de mauvaise qualité et a tendance à absorber l’humidité et les gâteaux.
- Méthode de neutralisation : Cette méthode implique la réaction d’une solution insaturée de fluorure d’ammonium et d’acide fluorhydrique , suivie de l’ajout d’une solution d’ammoniaque pour neutraliser l’excès d’acide fluorhydrique. Le produit est un cristal de difluorure d’ammonium relativement pur et stable. Cette méthode peut améliorer la qualité du produit et réduire la pollution de l’environnement.
Utilisations du bifluorure d’ammonium
Le difluorure d’ammonium est un sel inorganique qui a diverses utilisations dans différentes industries. Certaines des utilisations courantes sont :
- Gravure du verre : le difluorure d’ammonium peut attaquer le composant silice du verre et créer des motifs ou des dessins sur la surface. Il peut également éliminer les taches et la rouille de la verrerie.
- Traitement des métaux : Le difluorure d’ammonium peut agir comme agent complexant avec certains métaux et améliorer la qualité et l’apparence de la galvanoplastie. Il peut également éliminer les oxydes et le tartre des surfaces métalliques.
- Production de céramique : utilisé comme fondant dans la préparation de glaçures et d’émaux céramiques. Il peut également abaisser le point de fusion et la viscosité de certains matériaux céramiques.
- Synthèse organique : utilisé comme catalyseur ou réactif dans certaines réactions organiques, telles que la fluoration, la déprotection et le clivage.
- Digestion minérale : également utilisé comme agent fluorant puissant pour convertir certains minéraux et oxydes réfractaires en fluorures solubles. Cela peut faciliter la récupération des métaux précieux des minerais.
Des questions:
Q : Quelle est la densité apparente des sels de bifluorure d’ammonium ?
R : La densité apparente des sels de difluorure d’ammonium est de 1,5 g/cm3.
Q : À quoi sert le bifluorure d’ammonium ?
R : Le difluorure d’ammonium est utilisé à diverses fins, telles que la gravure du verre, le traitement des métaux, la production de céramique, la synthèse organique et la digestion minérale.
Q : Comment graver le verre avec du bifluorure d’ammonium ?
R : Pour graver le verre avec du difluorure d’ammonium, vous devez préparer une solution de sel dans l’eau et l’appliquer sur la surface du verre avec un pinceau ou un pochoir. La solution réagira avec le composant silice du verre et créera des motifs ou des dessins. Vous devez rincer le verre avec de l’eau et le sécher après gravure.
Q : Le bifluorure d’ammonium est-il sans danger sur les roues chromées ?
R : Le difluorure d’ammonium n’est pas sans danger sur les roues chromées, car il peut corroder le métal et endommager la finition. Il peut également provoquer de graves brûlures et lésions oculaires en cas de contact avec la peau ou les yeux. Vous devez éviter d’utiliser du difluorure d’ammonium sur les roues chromées et utiliser plutôt un nettoyant approprié.
Q : Quelle est la durée de conservation du bifluorure d’ammonium ?
R : La durée de conservation du difluorure d’ammonium dépend des conditions de stockage et de la pureté du produit. Généralement, il peut durer plusieurs années s’il est stocké dans un endroit frais, sec et bien ventilé dans un récipient bien fermé. Cependant, il peut absorber l’humidité de l’air et former des mottes ou des gâteaux avec le temps. Vous devez vérifier l’apparence et la qualité du produit avant de l’utiliser.
Q : Le bifluorure d’ammonium est-il un acide ?
R : Le difluorure d’ammonium n’est pas un acide, mais un sel qui contient un cation ammonium ( [NH4]+ ) et un anion difluorure ou hydrogène (difluorure) ( [HF2]− ). Cependant, il peut agir comme un composé acido-basique, car il peut libérer du fluorure d’hydrogène (HF), un acide fort, lorsqu’il est chauffé ou dissous dans l’eau.
