Le dichromate de sodium est un composé chimique. C’est un agent oxydant et une substance fortement toxique. Il est utilisé dans divers procédés industriels, tels que le placage métallique et la production de pigments.
| Nom UICPA | Bichromate de sodium |
| Formule moléculaire | Na2Cr2O7 |
| Numero CAS | 10588-01-9 |
| Synonymes | Bichromate de sodium, Dichromate disodique, Bichromate de soude |
| InChI | InChI=1S/2Cr.2Na.7O/q2*+6;2*+1;7*-2 |
Propriétés du dichromate de sodium
Formule de dichromate de sodium
La formule du bichromate de sodium est Na2Cr2O7. Il se compose de deux atomes de sodium (Na), de deux atomes de chrome (Cr) et de sept atomes d’oxygène (O). La formule représente le rapport de chaque élément du composé.
Dichromate De Sodium Masse molaire
La masse molaire du bichromate de sodium est calculée en additionnant les masses atomiques de tous ses éléments constitutifs. Le sodium (Na) a une masse atomique de 22,99 g/mol, le chrome (Cr) a une masse de 51,99 g/mol et l’oxygène (O) a une masse de 16,00 g/mol. L’addition de ces valeurs donne une masse molaire de 261,97 g/mol pour le bichromate de sodium.
Point d’ébullition du dichromate de sodium
Le bichromate de sodium a un point d’ébullition d’environ 400°C (752°F). Il s’agit de la température à laquelle le composé passe d’une phase liquide à une phase gazeuse lorsqu’il est chauffé sous pression atmosphérique normale.
Dichromate de sodium Point de fusion
Le point de fusion du bichromate de sodium est d’environ 357°C (675°F). C’est la température à laquelle le composé solide se transforme à l’état liquide. Il est important de noter que le point de fusion peut varier légèrement en fonction de la pureté de l’échantillon.
Densité du dichromate de sodium g/mL
La densité du bichromate de sodium est d’environ 2,52 g/mL. La densité est une mesure de la masse d’une substance par unité de volume. Dans le cas du bichromate de sodium, cette valeur indique qu’un volume donné du composé est relativement lourd.
Dichromate De Sodium Poids moléculaire
Le poids moléculaire du bichromate de sodium est de 261,97 g/mol. Cette valeur représente la somme des poids atomiques de tous les atomes présents dans une molécule du composé.
Structure du dichromate de sodium
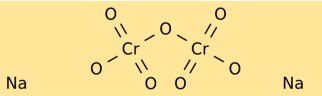
Le bichromate de sodium a une structure cristalline formant des cristaux rouge-orange vif. Il se compose d’ions sodium (Na+) et d’ions dichromates (Cr2O7^2-). L’ion dichromate possède un atome de chrome central lié à deux atomes d’oxygène d’un côté et à trois atomes d’oxygène de l’autre côté.
Solubilité du dichromate de sodium
Le bichromate de sodium est très soluble dans l’eau. Il se dissout facilement dans l’eau, formant une solution jaune-orange. La solubilité du bichromate de sodium dans l’eau est influencée par des facteurs tels que la température et le pH, des températures plus élevées et des niveaux de pH plus faibles augmentant sa solubilité.
| Apparence | Cristaux rouge-orange |
| Gravité spécifique | 2,52 |
| Couleur | Rouge-orange vif |
| Odeur | Inodore |
| Masse molaire | 261,97 g/mole |
| Densité | 2,52 g/ml |
| Point de fusion | 357°C (675°F) |
| Point d’ébullition | 400°C (752°F) |
| Point d’éclair | N’est pas applicable |
| Solubilité dans l’eau | Très soluble |
| Solubilité | Soluble dans l’eau, légèrement soluble dans l’éthanol/méthanol |
| Pression de vapeur | Pas disponible |
| Densité de vapeur | Pas disponible |
| pKa | Pas disponible |
| pH | Pas disponible |
Sécurité et dangers du dichromate de sodium
Le bichromate de sodium présente des risques importants pour la sécurité. Il est hautement toxique s’il est ingéré, inhalé ou absorbé par la peau. Cela peut provoquer de graves brûlures et des lésions oculaires au contact. Le composé est également classé comme cancérigène potentiel, capable de provoquer le cancer. De plus, c’est un agent oxydant, ce qui signifie qu’il peut réagir violemment avec les matériaux combustibles, augmentant ainsi le risque d’incendie ou d’explosion. Des précautions de sécurité appropriées doivent être prises lors de la manipulation du bichromate de sodium, y compris l’utilisation de vêtements, de gants et de lunettes de protection. Il doit être stocké dans un endroit sécurisé et bien ventilé, à l’écart des substances incompatibles. En cas d’exposition ou d’ingestion, des soins médicaux immédiats sont cruciaux.
| Symboles de danger | Corrosif, danger pour la santé |
| Description de la sécurité | Très toxique, corrosif, cancérigène |
| Numéros d’identification de l’ONU | UN3086 |
| Code SH | 28415000 |
| Classe de danger | 6.1 |
| Groupe d’emballage | II |
| Toxicité | Très toxique |
Méthodes de synthèse du dichromate de sodium
Il existe plusieurs méthodes pour synthétiser le bichromate de sodium. Une méthode couramment utilisée est la réaction entre le chromate de sodium (Na2CrO4) et le bichromate de sodium (Na2Cr2O7). L’acide sulfurique (H2SO4) réagit avec le chromate de sodium, produisant du bichromate de sodium et de l’eau. L’équation chimique de cette réaction est :
2Na2CrO4 + 2H2SO4 → Na2Cr2O7 + Na2SO4 + H2O
Une autre méthode implique l’oxydation du chromate de sodium à l’aide d’un agent oxydant puissant, tel que le permanganate de potassium (KMnO4) . Dans cette réaction, le chromate de sodium réagit avec le permanganate de potassium en présence d’acide sulfurique pour produire du bichromate de sodium, du dioxyde de manganèse (MnO2) et de l’eau.
2Na2CrO4 + 6KMnO4 + 7H2SO4 → 2Na2Cr2O7 + 6MnO2 + 7K2SO4 + 8H2O
La réaction entre l’hydroxyde de sodium (NaOH) et le trioxyde de chrome (CrO3) produit du bichromate de sodium. La réaction se déroule en milieu aqueux et produit du bichromate de sodium et de l’eau.
2NaOH + CrO3 → Na2Cr2O7 + H2O
Lors de la mise en œuvre de ces méthodes de synthèse, les individus doivent faire preuve de prudence en raison de la nature toxique et dangereuse du bichromate de sodium. L’utilisation de mesures de sécurité et d’équipements de protection appropriés est impérative pour garantir le bien-être des personnes impliquées dans le processus.
Utilisations du bichromate de sodium
Le bichromate de sodium a diverses applications dans différentes industries. Voici quelques-unes de ses utilisations :
- Placage de métal : les procédés de galvanoplastie utilisent du bichromate de sodium pour appliquer un revêtement protecteur et décoratif sur diverses surfaces métalliques, telles que l’acier, l’aluminium et le zinc.
- Production de pigments : le bichromate de sodium joue un rôle essentiel dans la production de pigments comme le jaune de chrome et le vert de chrome, largement présents dans les peintures, les encres et les colorants.
- Agent de préservation du bois : Le bichromate de sodium, avec ses fortes propriétés oxydantes, préserve le bois contre la pourriture, les insectes et les champignons, en particulier dans les applications extérieures.
- Tannage du cuir : L’industrie du tannage utilise du bichromate de sodium comme mordant pendant le processus de traitement du cuir, améliorant ainsi la solidité des couleurs et la durabilité du cuir.
- Synthèse chimique : Le bichromate de sodium agit comme réactif dans diverses réactions chimiques, notamment la synthèse de composés organiques, les réactions d’oxydation et la préparation d’autres composés du chrome.
- Applications en laboratoire : Le bichromate de sodium trouve des applications en laboratoire pour les tests analytiques, les étalons d’étalonnage et la recherche chimique.
- Industrie textile : Le bichromate de sodium améliore la solidité des couleurs et favorise une meilleure adhérence des colorants au tissu lors des processus de teinture et d’impression des textiles.
- Photographie : Le bichromate de sodium est un composant crucial dans les émulsions photosensibles et fonctionne comme un agent oxydant dans certains processus photographiques.
Il est important de manipuler le bichromate de sodium avec précaution, en suivant les consignes de sécurité et les méthodes d’élimination appropriées, en raison de sa toxicité et de son impact sur l’environnement.
Des questions:
Q : Combien d’atomes d’oxygène y a-t-il dans 3,00 g de bichromate de sodium, Na2Cr2O7 ?
R : Il y a 6,02 x 10^22 atomes d’oxygène dans 3,00 g de bichromate de sodium.
Q : Combien d’atomes d’oxygène y a-t-il dans 4,00 g de bichromate de sodium, Na2Cr2O7 ?
R : Il y a 8,03 x 10^22 atomes d’oxygène dans 4,00 g de bichromate de sodium.
Q : Combien d’atomes d’oxygène y a-t-il dans 5,00 g de bichromate de sodium, Na2Cr2O7 ?
R : Il y a 1,00 x 10^23 atomes d’oxygène dans 5,00 g de bichromate de sodium.
Q : Combien d’atomes d’oxygène y a-t-il dans 6,00 g de bichromate de sodium, Na2Cr2O7 ?
R : Il y a 1,20 x 10^23 atomes d’oxygène dans 6,00 g de bichromate de sodium.
Q : Combien d’atomes d’oxygène y a-t-il dans 7,00 g de dichromate de sodium ?
R : Il y a 1,40 x 10^23 atomes d’oxygène dans 7,00 g de bichromate de sodium.
Q : Fiche signalétique de dichromate de sodium ?
R : La fiche signalétique (MSDS) du bichromate de sodium fournit des informations détaillées sur ses propriétés, les précautions de manipulation et les mesures de sécurité.
Q : Qu’est-ce qui pourrait remplacer le dichromate de sodium ?
R : Les alternatives au bichromate de sodium incluent d’autres composés de chrome, tels que des sels de chrome trivalent ou des substances sans chrome, selon l’application spécifique.
Q : À quoi sert le dichromate de sodium ?
R : Le bichromate de sodium est utilisé comme agent oxydant, agent de préservation du bois et pigment, ainsi que dans divers processus industriels comme le placage de métal et le tannage du cuir.
Q : La solution de chromate jaune peut-elle être fabriquée à partir de dichromate de sodium dihydraté ?
R : Oui, une solution de chromate jaune peut être préparée en dissolvant du bichromate de sodium dihydraté dans l’eau.
Q : Quelle est la formule du bichromate de sodium ?
R : La formule du bichromate de sodium est Na2Cr2O7.
Q : Le dichromate de sodium est-il inorganique ?
R : Oui, le bichromate de sodium est un composé inorganique.
Q : Que teste le dichromate de sodium ?
R : Le bichromate de sodium peut être utilisé à des fins de tests, par exemple pour évaluer la présence de certaines substances ou surveiller des réactions chimiques spécifiques.
