Le bicarbonate de potassium (KHCO3) sert de sel cristallin blanc, largement utilisé comme agent levant en pâtisserie, comme agent extincteur et pour neutraliser l’acidité du sol en agriculture. De plus, il agit comme complément nutritionnel et joue un rôle dans des traitements médicaux spécifiques.
| Nom UICPA | Hydrogénocarbonate de potassium |
| Formule moléculaire | KHCO3 |
| Numero CAS | 298-14-6 |
| Synonymes | Carbonate acide de potassium, sel acide de potassium, hydrogénocarbonate de potassium, PCN 0775, E501 |
| InChI | InChI=1S/CH2O3.K/c2-1(3)4;/h(H2,2,3,4);/q;+1/p-1 |
Propriétés du bicarbonate de potassium
Formule de bicarbonate de potassium
La formule du bicarbonate de potassium est KHCO3. Cette formule indique qu’un ion potassium (K+) est combiné avec un ion bicarbonate (HCO3-) pour former une molécule de bicarbonate de potassium. La formule est importante en chimie car elle fournit des informations sur les types et le nombre d’atomes qui composent une molécule.
Bicarbonate De Potassium Masse molaire
KHCO3 a une masse molaire de 100,115 g/mol. Cela signifie qu’une mole de KHCO3 contient 100,115 grammes du composé. La masse molaire est une propriété importante d’un composé, car elle est utilisée pour calculer la quantité d’une substance nécessaire à une réaction chimique. De plus, la masse molaire peut être utilisée pour convertir les grammes et les moles d’une substance.
Point d’ébullition du bicarbonate de potassium
Le point d’ébullition du KHCO3 n’est pas bien défini puisqu’il se décompose avant d’atteindre son point d’ébullition. Lorsqu’il est chauffé, le KHCO3 se décompose en carbonate de potassium, en dioxyde de carbone et en eau. Par conséquent, la température de décomposition du KHCO3 est utilisée pour décrire sa stabilité thermique.
Bicarbonate de Potassium Point de fusion
KHCO3 a un point de fusion de 292°C. À cette température, KHCO3 se transforme d’un solide à un liquide. Le point de fusion d’un composé est une propriété physique importante car elle détermine les conditions dans lesquelles le composé peut être fondu et traité.
Densité du bicarbonate de potassium g/mL
La densité du KHCO3 est de 2,17 g/mL. La densité est une mesure de la quantité de masse par unité de volume. La haute densité du KHCO3 en fait un composé utile dans des applications telles que les extincteurs, où il est utilisé pour éteindre les incendies de classe B.
Bicarbonate De Potassium Poids moléculaire
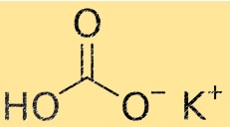
Le poids moléculaire du KHCO3 est de 100,115 g/mol. Le poids moléculaire est la somme des poids atomiques de tous les atomes d’une molécule. Cette propriété est importante en chimie car elle est utilisée pour calculer la quantité d’une substance nécessaire à une réaction chimique.
Structure du bicarbonate de potassium
KHCO3 a une structure cristalline similaire à celle du chlorure de sodium. Le composé est composé d’ions potassium (K+) et d’ions bicarbonate (HCO3-). Les ions potassium occupent les positions des ions sodium dans la structure cristalline du chlorure de sodium, tandis que les ions bicarbonate occupent les positions des ions chlorure.
| Apparence | Poudre cristalline blanche |
| Gravité spécifique | 2,17 g/cm³ |
| Couleur | Blanc |
| Odeur | Inodore |
| Masse molaire | 100,115 g/mole |
| Densité | 2,17 g/cm³ |
| Point de fusion | 292 °C |
| Point d’ébullition | Se décompose avant de bouillir |
| Point d’éclair | N’est pas applicable |
| Solubilité dans l’eau | 25 g/100 ml (20 °C) |
| Solubilité | Soluble dans l’eau |
| Pression de vapeur | N’est pas applicable |
| Densité de vapeur | N’est pas applicable |
| pKa | 10,3 (acide carbonique) |
| pH | 8,5 – 9,5 (solution à 1 %) |
Sécurité et dangers du bicarbonate de potassium
KHCO3 est généralement considéré comme sûr lorsqu’il est utilisé selon les instructions. Cependant, il peut provoquer une irritation de la peau et des yeux et doit être manipulé avec précaution. Il peut également être nocif s’il est ingéré en grande quantité. L’inhalation de poussière peut provoquer une irritation des voies respiratoires. De plus, il peut réagir avec des acides forts pour libérer du dioxyde de carbone, ce qui peut être dangereux. Lors de l’utilisation de KHCO3, il est important de suivre les procédures de sécurité et de porter un équipement de protection approprié. En cas d’ingestion, consulter immédiatement un médecin. En cas de contact avec la peau ou les yeux, laver soigneusement la zone affectée avec de l’eau et consulter un médecin si l’irritation persiste.
| Symboles de danger | Aucun |
| Description de la sécurité | Nocif en cas d’ingestion, provoque une irritation de la peau et des yeux. Évitez l’inhalation. |
| Numéros d’identification de l’ONU | ONU 2987 |
| Code SH | 2836.30.00 |
| Classe de danger | 8 (Corrosif) |
| Groupe d’emballage | III |
| Toxicité | DL50 (rat, orale) : 6 400 mg/kg |
Méthodes de synthèse du bicarbonate de potassium
En présence d’eau, le dioxyde de carbone réagit avec le carbonate de potassium pour synthétiser le KHCO3.
La réaction se produit comme suit :
K2CO3 + CO2 + H2O → 2KHCO3
Une autre méthode consiste à faire réagir l’hydroxyde de potassium avec du dioxyde de carbone :
KOH + CO2 → KHCO3
Le KHCO3 résultant peut ensuite être purifié par recristallisation dans l’eau. Le rendement de la réaction dépend de la pureté des matières premières et des conditions de réaction.
Pour produire du KHCO3, on peut faire réagir du chlorure de potassium avec du bicarbonate d’ammonium, puis traiter le mélange obtenu avec du dioxyde de carbone.
NH4HCO3 + KCl → NH4Cl + KHCO3
KHCO3 + CO2 → K2CO3 + H2O
K2CO3 + CO2 + H2O → 2KHCO3
Cette méthode présente l’avantage d’utiliser des matières premières peu coûteuses et ne produit aucun sous-produit dangereux.
Utilisations du bicarbonate de potassium
KHCO3 a un large éventail d’utilisations dans diverses industries et applications. Voici quelques-unes des utilisations les plus courantes :
- Industrie alimentaire : utilisé comme agent levant dans les produits de boulangerie, tels que les gâteaux, les biscuits et le pain, pour les aider à lever.
- Agriculture : Utilisé comme fongicide pour lutter contre les maladies fongiques des plantes, comme l’oïdium.
- Produits pharmaceutiques : utilisés dans les antiacides pour neutraliser l’acide gastrique et traiter l’indigestion et les brûlures d’estomac.
- Extincteurs : Utilisé dans les extincteurs comme agent chimique sec pour éteindre les incendies de classe B et de classe C.
- Applications en laboratoire : Utilisé dans diverses applications de laboratoire, telles que le tamponnage du pH et la culture cellulaire.
- Produits de soins personnels : Utilisés dans les dentifrices comme abrasifs doux et dans les déodorants pour aider à contrôler les odeurs.
- Traitement de l’eau : Utilisé dans le traitement de l’eau pour ajuster le niveau de pH et éliminer les métaux lourds et autres impuretés.
Des questions:
Q : Qu’est-ce que le bicarbonate de potassium ?
R : Le KHCO3 est une poudre blanche et inodore couramment utilisée dans diverses industries, telles que l’alimentation, l’agriculture et les produits pharmaceutiques. Il a la formule chimique KHCO3 et est un sel composé de cation potassium, d’anion bicarbonate et de molécules d’eau.
Q : Le bicarbonate contenu dans les comprimés effervescents de potassium se transforme-t-il en dioxyde de carbone ?
R : Oui, lorsque les comprimés effervescents de potassium se dissolvent dans l’eau, le bicarbonate contenu dans le comprimé réagit avec l’acide citrique pour libérer du dioxyde de carbone. Cette réaction produit le pétillement et le bouillonnement caractéristiques associés aux comprimés effervescents.
Q : Que se passe-t-il après avoir ajouté du bicarbonate de potassium au vin ?
UN: L’ajout de KHCO3 au vin réduit l’acidité du vin en réagissant avec l’excès d’acide présent. Les vignerons utilisent couramment ce processus, appelé désacidification, pour améliorer le goût et la qualité du vin.
Q : Où acheter du bicarbonate de potassium ?
R : KHCO3 peut être acheté auprès de divers fournisseurs de produits chimiques, de marchés en ligne et de magasins de fournitures agricoles. Il est également couramment disponible dans les magasins d’aliments naturels et sur les marchés d’aliments naturels.
Q : Quel est le nom du composé de formule KHCO3 ?
R : Le composé de formule KHCO3 est appelé bicarbonate de potassium.
Q : Qu’a-t-on fait dans l’expérience pour s’assurer que tout le KHCO3 avait réagi ?
R : Dans l’expérience visant à garantir que tout le KHCO3 avait réagi, un excès d’acide a été ajouté au mélange réactionnel et la réaction a été poursuivie jusqu’à ce qu’il n’y ait plus de production de gaz. L’absence de gaz indiquait que tout le KHCO3 avait réagi avec l’acide.
Q : Que se passe-t-il si vous chauffez du KHCO3 ?
R : Lorsque le KHCO3 est chauffé, il se décompose pour former du carbonate de potassium (K2CO3), de l’eau et du dioxyde de carbone. Cette réaction se produit comme suit : 2KHCO3 → K2CO3 + H2O + CO2.
