Le bicarbonate de calcium (Ca(HCO3)2) est un composé qui contient du calcium, du carbone et de l’oxygène. On le trouve couramment dans l’eau minérale et est important pour la santé des os et la fonction musculaire.
| Nom UICPA | Hydrogénocarbonate de calcium |
| Formule moléculaire | Ca(HCO3)2 |
| Numero CAS | 3983-19-5 |
| Synonymes | Carbonate acide de calcium, hydrogénocarbonate de calcium, bicarbonate de calcium hydraté, hydrogénocarbonate de calcium hydraté, EINECS 223-070-3 |
| InChI | InChI=1S/C2H2O3.Ca/c3-1(4)2(5)6;/h(H2,3,4)(H,5,6);/q;+2/p-2 |
Propriétés du bicarbonate de calcium
Formule de bicarbonate de calcium
La formule chimique du bicarbonate de calcium est Ca(HCO3)2. Cela indique que le composé est constitué d’un ion Ca2+ et de deux ions HCO3-. La formule est importante pour comprendre la composition du composé et ses propriétés chimiques. Le Ca(HCO3)2 peut être formé en dissolvant du carbonate de calcium dans de l’eau gazeuse ou en faisant réagir de l’hydroxyde de calcium avec du dioxyde de carbone.
Bicarbonate De Calcium Masse molaire
La masse molaire de Ca(HCO3)2 est de 162,114 g/mol. Ceci est calculé en additionnant les masses atomiques de chaque élément du composé. Ca(HCO3)2 contient des atomes de calcium, d’hydrogène, de carbone et d’oxygène, et la masse molaire reflète la masse combinée de tous ces atomes. Connaître la masse molaire est important pour déterminer la quantité de Ca(HCO3)2 nécessaire aux réactions chimiques ou pour déterminer la concentration d’une solution.
Point d’ébullition du bicarbonate de calcium
Le Ca(HCO3)2 se décompose avant d’atteindre son point d’ébullition. À pression atmosphérique normale, Ca(HCO3)2 se décompose en carbonate de calcium, eau et dioxyde de carbone à des températures supérieures à 50°C. Il n’a donc pas de point d’ébullition.
Bicarbonate de Calcium Point de fusion
Le Ca(HCO3)2 n’a pas de point de fusion distinct car il se décompose avant d’atteindre son point de fusion. Il se décompose en carbonate de calcium, eau et dioxyde de carbone à des températures supérieures à 50°C. Cependant, la décomposition thermique du Ca(HCO3)2 peut être utilisée pour produire de l’oxyde de calcium, qui a un point de fusion élevé de 2 613 °C.
Densité du bicarbonate de calcium g/mL
La densité de Ca(HCO3)2 est de 2,21 g/mL. Cela signifie qu’un centimètre cube de Ca(HCO3)2 pèse 2,21 grammes. La densité du Ca(HCO3)2 est inférieure à la densité du carbonate de calcium, qui est de 2,71 g/mL. La densité d’une substance est importante pour déterminer la masse d’une substance par unité de volume et peut être utilisée pour calculer la concentration d’une solution.
Bicarbonate De Calcium Poids moléculaire
Le poids moléculaire de Ca(HCO3)2 est de 162,114 g/mol. Cette valeur est calculée en additionnant les poids atomiques du calcium, de l’hydrogène, du carbone et de l’oxygène dans le composé. Le poids moléculaire est important pour déterminer la quantité de Ca(HCO3)2 nécessaire aux réactions chimiques et pour déterminer la concentration d’une solution.
Structure du bicarbonate de calcium
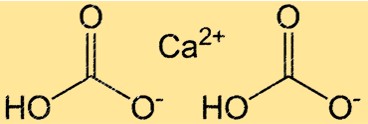
Ca(HCO3)2 a une structure complexe en raison de la présence de liaisons ioniques et covalentes. Le composé est constitué d’un ion Ca2+ et de deux ions HCO3- maintenus ensemble par des liaisons ioniques. L’ion HCO3- lui-même est un ion polyatomique constitué d’un atome de carbone, de deux atomes d’oxygène et d’un atome d’hydrogène. L’atome de carbone est doublement lié à un atome d’oxygène et simplement lié à l’autre, et l’atome d’hydrogène est attaché à l’un des atomes d’oxygène. La structure du Ca(HCO3)2 est importante pour comprendre sa réactivité et sa solubilité dans l’eau.
| Apparence | poudre blanche |
| Gravité spécifique | 2,21 g/cm³ |
| Couleur | Incolore |
| Odeur | Inodore |
| Masse molaire | 162,114 g/mole |
| Densité | 2,21 g/ml |
| Point de fusion | Se décompose au-dessus de 50°C |
| Point d’ébullition | Se décompose au-dessus de 50°C |
| Point d’éclair | N’est pas applicable |
| Solubilité dans l’eau | Soluble |
| Solubilité | Soluble dans l’eau, insoluble dans l’alcool |
| Pression de vapeur | Négligeable |
| Densité de vapeur | N’est pas applicable |
| pKa | 6.4 – 10.3 |
| pH | 8.2 – 8.4 |
Sécurité et dangers du bicarbonate de calcium
Le Ca(HCO3)2 est généralement considéré comme sans danger pour une utilisation dans les aliments et les boissons par les agences de réglementation. Cependant, l’inhalation de poussières de Ca(HCO3)2 peut provoquer une irritation des voies respiratoires. Le contact avec les yeux peut provoquer une irritation ou des lésions cornéennes. L’ingestion de grandes quantités de Ca(HCO3)2 peut provoquer une irritation gastro-intestinale. La manipulation du Ca(HCO3)2 peut également provoquer une irritation cutanée ou une dermatite chez les personnes sensibles. Il est important de suivre les procédures de manipulation appropriées lorsque vous travaillez avec du Ca(HCO3)2, comme le port de gants et de lunettes de protection. De plus, il est important de stocker le Ca(HCO3)2 dans un endroit frais et sec et à l’écart des substances incompatibles.
| Symboles de danger | Aucun |
| Description de la sécurité | Non toxique et sûr |
| Numéros d’identification de l’ONU | N / A |
| Code SH | 2836.50.00 |
| Classe de danger | Non dangereux |
| Groupe d’emballage | N / A |
| Toxicité | Non toxique et sûr |
Méthodes de synthèse du bicarbonate de calcium
La réaction du carbonate de calcium (CaCO3) avec le dioxyde de carbone (CO2) et l’eau (H2O) synthétise le Ca(HCO3)2. Cette réaction peut se produire naturellement dans certaines masses d’eau, où sont présents du dioxyde de carbone et du carbonate de calcium .
Pour produire du Ca(HCO3)2, on peut faire passer du dioxyde de carbone à travers une solution d’ hydroxyde de calcium (Ca(OH)2) . Cette réaction forme du carbonate de calcium , qui réagit ensuite avec l’excès de dioxyde de carbone pour former du Ca(HCO3)2.
Une autre méthode de synthèse du Ca(HCO3)2 consiste à faire réagir du chlorure de calcium (CaCl2) avec du bicarbonate de sodium (NaHCO3). Cette réaction produit du Ca(HCO3)2 ainsi que du chlorure de sodium (NaCl) et du dioxyde de carbone.
Il est important de noter que le Ca(HCO3)2 est un composé relativement instable et se décompose en carbonate de calcium et en dioxyde de carbone en présence de chaleur ou de conditions acides. Pour éviter la décomposition, il faut manipuler et stocker le Ca(HCO3)2 avec précaution.
Utilisations du bicarbonate de calcium
Voici quelques utilisations courantes du Ca(HCO3)2 :
- Aliments et boissons : Utilisé comme additif alimentaire dans la production de certains produits de boulangerie, agents levants et boissons gazeuses.
- Traitement de l’eau : utilisé pour augmenter l’alcalinité de l’eau, ce qui aide à prévenir la corrosion des tuyaux et à réduire l’acidité des sources d’eau acides.
- Agriculture : Utilisé comme amendement du sol pour augmenter la teneur en calcium du sol, ce qui peut améliorer la structure du sol et la croissance des plantes.
- Produits pharmaceutiques : Utilisé dans certaines formulations antiacides comme agent neutralisant pour aider à soulager les brûlures d’estomac et l’indigestion.
- Construction : Utilisé comme source de calcium dans la production de certains matériaux de construction, comme le ciment et le plâtre.
- Nettoyage : Utilisé comme abrasif doux dans certains produits de nettoyage, tels que le dentifrice et les poudres de nettoyage.
- Cosmétiques : Utilisé comme agent tampon dans certaines formulations cosmétiques pour aider à maintenir le pH du produit.
Des questions:
Q : Qu’est-ce que le bicarbonate de calcium ?
R : Ca(HCO3)2 est une poudre cristalline blanche qui se forme lorsque le carbonate de calcium réagit avec le dioxyde de carbone et l’eau.
Q : Quelles sont les trois substances qui doivent interagir pour former du bicarbonate de calcium ?
R : Le carbonate de calcium, le dioxyde de carbone et l’eau doivent interagir pour former du Ca(HCO3)2.
Q : Le bicarbonate de calcium est-il un agent levant ?
R : Oui, le Ca(HCO3)2 peut être utilisé comme agent levant en pâtisserie pour aider la pâte à lever.
Q : Les cristaux auriculaires de bicarbonate de calcium se dissolvent-ils parfois ?
R : Oui, les cristaux auriculaires de Ca(HCO3)2 peuvent se dissoudre d’eux-mêmes ou avec un traitement, par exemple via l’utilisation de certains médicaments ou de certaines manœuvres.
Q : Quel est le nombre total de moles d’atomes dans une mole de Ca(HCO3)2 ?
R : Il y a 10 moles d’atomes dans une mole de Ca(HCO3)2.
Q : Combien d’atomes y a-t-il dans Ca(HCO3)2 ?
R : Il y a un total de 18 atomes présents dans Ca(HCO3)2, dont 1 atome de calcium, 2 atomes de carbone, 6 atomes d’hydrogène et 9 atomes d’oxygène.
Q : Qu’est-ce que le Ca(HCO3)2 ?
R : Ca(HCO3)2 est la formule chimique du bicarbonate de calcium, qui est un composé formé lorsque le carbonate de calcium réagit avec le dioxyde de carbone et l’eau.
