Le bicarbonate d’ammonium est un composé cristallin blanc utilisé en pâtisserie comme agent levant. Il libère du dioxyde de carbone lorsqu’il est chauffé, ce qui donne des produits de boulangerie légers et moelleux.
| Nom UICPA | Bicarbonate d’ammonium |
| Formule moléculaire | NH4HCO3 |
| Numero CAS | 1066-33-7 |
| Synonymes | Carbonate d’ammonium acide ; ammoniaque de boulangerie; Sel d’ammonium de l’acide carbonique (1:1); Carbonate acide d’ammonium |
| InChI | InChI=1S/CH2O3.H3N/c2-1(3)4;/h(H2,2,3,4);1H3 |
Veuillez noter que la valeur InChI fournie est une représentation simplifiée et peut ne pas être complète.
Propriétés du bicarbonate d’ammonium
Formule de bicarbonate d’ammonium
La formule chimique du bicarbonate d’ammonium est NH4HCO3. Il se compose d’un ion ammonium (NH4+) et d’un ion bicarbonate (HCO3-). Cette formule représente la composition du composé, indiquant la présence de groupes ammonium et bicarbonate.
Bicarbonate D’Ammonium Masse molaire
La masse molaire de l’hydrogénocarbonate d’ammonium est calculée en additionnant les masses atomiques de ses éléments constitutifs. Pour l’hydrogénocarbonate d’ammonium (NH4HCO3), la masse molaire est d’environ 79,06 grammes par mole. Cette valeur est importante pour divers calculs et conversions chimiques.
Point d’ébullition du bicarbonate d’ammonium
Le carbonate acide d’ammonium n’a pas de point d’ébullition distinct car il se décompose en produits gazeux lorsqu’il est chauffé. Cependant, le processus de décomposition commence vers 60 à 70 degrés Celsius. À mesure que la température augmente, le composé se décompose en ammoniac (NH3), eau (H2O) et dioxyde de carbone (CO2).
Bicarbonate d’Ammonium Point de fusion
Le point de fusion de l’hydrogénocarbonate d’ammonium est d’environ 41 à 60 degrés Celsius. Lorsqu’il est chauffé, le composé subit une sublimation, passant directement d’un solide à un gaz sans passer par la phase liquide.
Densité du bicarbonate d’ammonium g/mL
La densité de l’hydrogénocarbonate d’ammonium est d’environ 1,59 grammes par millilitre (g/mL) à température ambiante. Cette valeur représente la masse du composé par unité de volume. La densité de l’hydrogénocarbonate d’ammonium affecte son comportement dans diverses applications et sa solubilité dans différents solvants.
Bicarbonate D’Ammonium Poids moléculaire
Le poids moléculaire de l’hydrogénocarbonate d’ammonium est d’environ 79,06 grammes par mole. Cette valeur est obtenue en additionnant les masses atomiques des éléments présents dans le composé (azote, hydrogène, carbone et oxygène). Le poids moléculaire est essentiel pour calculer la quantité d’hydrogénocarbonate d’ammonium nécessaire aux réactions chimiques.
Structure du bicarbonate d’ammonium
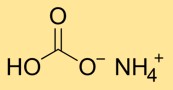
L’hydrogénocarbonate d’ammonium a une structure cristalline composée d’ions ammonium (NH4+) et bicarbonate (HCO3-). L’ion ammonium est formé par la combinaison d’un atome d’azote et de quatre atomes d’hydrogène, tandis que l’ion bicarbonate est constitué d’un atome de carbone lié à trois atomes d’oxygène.
Solubilité du bicarbonate d’ammonium
L’hydrogénocarbonate d’ammonium est très soluble dans l’eau. Il se dissout facilement dans les solutions aqueuses, libérant des ions ammonium et des ions bicarbonate. Cependant, sa solubilité diminue avec la température. Il est peu soluble dans l’alcool et insoluble dans la plupart des solvants organiques.
| Apparence | Poudre cristalline blanche |
| Gravité spécifique | 1,586 g/cm³ |
| Couleur | Incolore |
| Odeur | Odeur d’ammoniaque |
| Masse molaire | 79,06 g/mole |
| Densité | 1,59 g/ml |
| Point de fusion | 41-60 °C |
| Point d’ébullition | Se décompose |
| Point d’éclair | N’est pas applicable |
| Solubilité dans l’eau | Soluble |
| Solubilité | Soluble dans l’eau; peu soluble dans l’alcool |
| Pression de vapeur | N’est pas applicable |
| Densité de vapeur | N’est pas applicable |
| pKa | N’est pas applicable |
| pH | ~7 |
Veuillez noter que les valeurs fournies sont approximatives et peuvent varier en fonction de facteurs tels que la pureté et les conditions environnementales.
Sécurité et dangers du bicarbonate d’ammonium
L’hydrogénocarbonate d’ammonium présente certaines considérations et dangers en matière de sécurité. Il peut irriter les yeux, la peau et le système respiratoire par contact ou par inhalation. L’exposition directe peut provoquer un inconfort, notamment des sensations de brûlure. Il est important de manipuler le composé avec précaution et d’utiliser un équipement de protection individuelle approprié, tel que des gants et des lunettes. De plus, l’hydrogénocarbonate d’ammonium peut libérer du gaz ammoniac nocif lorsqu’il est chauffé, une ventilation adéquate est donc nécessaire dans de telles situations. Le composé n’est pas inflammable et n’a pas de point d’éclair spécifique. Un stockage, un étiquetage et un respect appropriés des protocoles de sécurité sont essentiels pour minimiser les risques associés à la manipulation et à l’utilisation de l’hydrogénocarbonate d’ammonium.
| Symboles de danger | Xi (Irritant) |
| Description de la sécurité | – Éviter tout contact avec les yeux, la peau et l’inhalation.\n- Utiliser un équipement de protection individuelle approprié.\n- Assurer une ventilation adéquate lors de la manipulation.\n- Stocker correctement et étiqueter les conteneurs.\n- Suivre les protocoles de sécurité. |
| Numéros d’identification de l’ONU | N’est pas applicable |
| Code SH | 28369990 |
| Classe de danger | Non classés |
| Groupe d’emballage | Non classés |
| Toxicité | Faible toxicité ; irritant pour les yeux, la peau et le système respiratoire. |
Veuillez noter que les informations fournies sont de nature générale et peuvent ne pas couvrir tous les aspects de la sécurité et des dangers liés à l’hydrogénocarbonate d’ammonium. Il est important de se référer aux fiches de données de sécurité et aux réglementations spécifiques pour obtenir des conseils complets.
Méthodes de synthèse du bicarbonate d’ammonium
Il existe plusieurs méthodes de synthèse de l’hydrogénocarbonate d’ammonium.
Une méthode courante implique la réaction entre l’ammoniac gazeux (NH3) et le dioxyde de carbone (CO2) dans une solution aqueuse. Dans ce processus, vous faites barboter les deux gaz directement dans l’eau et l’eau forme une solution d’hydrogénocarbonate d’ammonium. Ensuite, vous concentrez et cristallisez la solution pour obtenir le composé solide.
Une autre approche est la réaction entre l’ammoniac et le dioxyde de carbone dans un solvant, tel que le méthanol ou l’éthanol. La réaction se déroule sous pression et à température élevée, entraînant la formation de cristaux d’hydrogénocarbonate d’ammonium.
Le traitement du carbonate d’ammonium avec du dioxyde de carbone produit du bicarbonate d’ammonium et de l’eau. Le carbonate d’ammonium , que ce soit sous sa forme solide ou en solution, réagit avec le dioxyde de carbone pour produire du bicarbonate d’ammonium.
Pour synthétiser l’hydrogénocarbonate d’ammonium, on peut combiner l’ammoniac avec de l’acide carbonique. L’acide carbonique se forme en dissolvant le dioxyde de carbone dans l’eau et l’ajout d’ammoniac à la solution d’acide carbonique résultante produit du carbonate acide d’ammonium.
Assurez-vous que la synthèse de l’hydrogénocarbonate d’ammonium a lieu dans un endroit bien ventilé en raison du dégagement d’ammoniac gazeux pendant les réactions. Suivez les mesures de sécurité et les protocoles de manipulation appropriés pour garantir un processus de synthèse sûr et efficace.
Utilisations du bicarbonate d’ammonium
L’hydrogénocarbonate d’ammonium trouve diverses utilisations dans différentes industries et applications. Voici quelques-unes de ses utilisations courantes :
- Cuisson : L’hydrogénocarbonate d’ammonium sert d’agent levant dans la pâtisserie, en particulier pour les biscuits, les craquelins et autres produits de boulangerie. Il libère du dioxyde de carbone lorsqu’il est chauffé, créant une texture légère et croustillante.
- Production d’ammoniac : L’hydrogénocarbonate d’ammonium sert de composé intermédiaire dans la production d’ammoniac. Il peut se décomposer en ammoniac et en dioxyde de carbone, qui peuvent ensuite être séparés et utilisés à diverses fins.
- Agriculture : Les agriculteurs l’utilisent comme source d’azote dans les engrais pour fournir les nutriments essentiels à la croissance des plantes. Les plantes l’absorbent facilement grâce à sa solubilité dans l’eau.
- Contrôle du pH : les industries utilisent du carbonate acide d’ammonium pour ajuster les niveaux de pH dans des processus tels que le traitement de l’eau, la fabrication de colorants et la production de pigments.
- Extincteurs : Certains extincteurs à poudre sèche utilisent ce composé comme extincteur. Il étouffe les flammes et perturbe le processus de combustion.
- Agent de nettoyage : Certaines industries l’utilisent comme agent de nettoyage pour éliminer la saleté, la graisse et les contaminants des surfaces.
- Industrie textile et cuir : Dans les processus de teinture et d’impression des textiles et de la maroquinerie, l’hydrogénocarbonate d’ammonium aide à fixer les colorants et à améliorer la solidité des couleurs.
- Applications pharmaceutiques : Il trouve une application dans certaines formulations pharmaceutiques comme agent tampon ou ingrédient dans des comprimés médicinaux.
Les diverses applications de l’hydrogénocarbonate d’ammonium mettent en évidence sa polyvalence et son utilité dans de multiples industries, notamment dans la boulangerie, l’agriculture, le contrôle du pH, la suppression des incendies et divers processus de fabrication.
Des questions:
Q : Le bicarbonate d’ammonium est-il mauvais pour vous ?
R : Le carbonate acide d’ammonium peut être nocif s’il est ingéré ou inhalé en grande quantité, provoquant une irritation du système respiratoire et de la peau. Il doit être manipulé et utilisé avec les précautions appropriées.
Q : Comment séparer le carbonate d’ammonium du bicarbonate d’ammonium ?
R : Le carbonate d’ammonium peut être séparé de l’hydrogénocarbonate d’ammonium en chauffant le mélange, car le bicarbonate d’ammonium se décompose en ammoniac, dioxyde de carbone et eau, laissant derrière lui du carbonate d’ammonium.
Q : Comment calculez-vous le pH du bicarbonate d’ammonium dans l’eau ?
R : Le pH de l’hydrogénocarbonate d’ammonium dans l’eau peut être calculé à l’aide de l’équation de Henderson-Hasselbalch : pH = pKa + log([A-]/[HA]), où pKa est la constante de dissociation acide et [A-]/[ HA] représente le rapport entre la base conjuguée et l’acide.
Q : Comment ajuster le pH du tampon bicarbonate d’ammonium ?
R : Le pH d’un tampon d’hydrogénocarbonate d’ammonium peut être ajusté en ajoutant soit un acide fort pour abaisser le pH, soit une base forte pour augmenter le pH tout en maintenant le rapport approprié entre le bicarbonate d’ammonium et sa base conjuguée.
Q : Le bicarbonate d’ammonium est-il sans danger dans les aliments ?
R : L’hydrogénocarbonate d’ammonium est généralement reconnu comme étant sans danger (GRAS) pour une utilisation dans les aliments, mais il doit être utilisé conformément aux directives réglementaires et en quantités appropriées.
Q : Qu’est-ce qu’un tampon au bicarbonate d’ammonium ?
R : Le tampon hydrogénocarbonate d’ammonium est une solution contenant de l’hydrogénocarbonate d’ammonium et sa base conjuguée (ou acide), utilisée pour maintenir un pH stable dans diverses applications biochimiques et biologiques.
Q : Quelle est la masse moléculaire du bicarbonate d’ammonium ?
R : La masse moléculaire de l’hydrogénocarbonate d’ammonium est d’environ 79,06 g/mol.
Q : Quelle est la composition en pourcentage en masse de l’hydrogène dans NH4HCO3 ?
R : La composition en pourcentage en masse d’hydrogène dans NH4HCO3 est d’environ 6,57 %.
Q : Le NH4HCO3 est-il un acide ou une base ?
R : Le NH4HCO3 peut agir à la fois comme acide et comme base, selon le contexte. Il peut donner un proton (H+) pour agir comme acide ou accepter un proton pour agir comme base.
Q : Quel est le nom du composé de formule NH4HCO3 ?
R : Le composé de formule NH4HCO3 est appelé hydrogénocarbonate d’ammonium.
Q : Le NH4HCO3 est-il ionique ou covalent ?
R : NH4HCO3 est considéré comme un composé ionique en raison de la présence de l’ion ammonium (NH4+) et de l’ion hydrogénocarbonate (HCO3-) dans sa structure.
