L’azoture de sodium (NaN3) est un composé chimique. C’est hautement toxique et explosif. Il est utilisé dans les airbags pour générer rapidement de l’azote gazeux pour le gonflage lors de l’impact.
| Nom UICPA | De l’azide de sodium |
| Formule moléculaire | NaN3 |
| Numero CAS | 26628-22-8 |
| Synonymes | Azium, sel de sodium de l’acide hydrazoïque, trinitrure de sodium |
| InChI | InChI=1S/3HNO.Na/c1-4-2;2-1-3;/h3*1H;/q;;;+1/p-1 |
Propriétés de l’azoture de sodium
Formule d’azoture de sodium
La formule de l’azoture de sodium est NaN3. Il se compose d’un atome de sodium (Na) et de trois atomes d’azote (N). L’atome de sodium est chargé positivement, tandis que les atomes d’azote sont chargés négativement. La formule représente le rapport entre les atomes de sodium et d’azote dans le composé.
Azoture De Sodium Masse molaire
La masse molaire du sodiumazide est calculée en additionnant les masses atomiques de ses constituants. Le sodium a une masse molaire de 22,99 g/mol et l’azote a une masse molaire de 14,01 g/mol. Puisqu’il y a trois atomes d’azote dans l’azide de sodium, on multiplie la masse molaire de l’azote par trois. L’addition de ces valeurs donne une masse molaire d’environ 65,01 g/mol pour le sodiumazide.
Point d’ébullition de l’azoture de sodium
Le sodiumazide a un point d’ébullition élevé. Lorsqu’il est chauffé, il subit une décomposition plutôt qu’une ébullition. À des températures supérieures à 275 degrés Celsius (527 degrés Fahrenheit), il se décompose rapidement en sodium métallique et en azote gazeux. Son point d’ébullition n’est donc pas bien défini.
Azoture de sodium Point de fusion
Le point de fusion du sodiumazide est relativement bas par rapport à son point d’ébullition. Il fond à environ 275 degrés Celsius (527 degrés Fahrenheit). Le composé passe de l’état solide à l’état liquide à cette température. Cependant, il est important de manipuler le sodiumazide avec prudence en raison de sa nature toxique et explosive.
Densité d’azoture de sodium g/mL
La densité du sodiumazide est généralement exprimée en grammes par millilitre (g/mL). La densité approximative du sodiumazide solide est d’environ 1,85 g/mL. Cependant, il convient de noter que la densité peut varier légèrement en fonction de facteurs tels que la température et la pression.
Azide De Sodium Poids moléculaire
Le poids moléculaire du sodiumazide est la somme des masses atomiques de ses éléments constitutifs. Comme mentionné précédemment, l’azide de sodium est constitué d’un atome de sodium et de trois atomes d’azote. En additionnant les masses atomiques de ces éléments, on obtient un poids moléculaire d’environ 65,01 grammes par mole (g/mol).
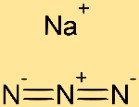
Structure de l’azoture de sodium
La structure du sodiumazide est constituée d’une alternance de cations sodium (Na+) et d’anions azide (N3-). L’ion sodium est entouré de trois atomes d’azote, chacun partageant une paire électronique avec l’atome de sodium. Cet arrangement crée une structure de réseau cristallin stable pour le sodiumazide.
Solubilité de l’azoture de sodium
Le sodiumazide est modérément soluble dans l’eau. Il se dissout dans l’eau pour former une solution claire. La solubilité du sodiumazide augmente avec des températures plus élevées. Cependant, il est important de manipuler la solution avec précaution en raison de la nature toxique et explosive du sodiumazide.
| Apparence | Solide blanc |
| Gravité spécifique | 1,85 g/ml |
| Couleur | Incolore |
| Odeur | Inodore |
| Masse molaire | 65,01 g/mole |
| Densité | 1,85 g/ml |
| Point de fusion | 275°C |
| Point d’ébullition | Se décompose |
| Point d’éclair | N’est pas applicable |
| Solubilité dans l’eau | Modérément soluble |
| Solubilité | Soluble dans les solvants polaires comme l’ammoniac |
| Pression de vapeur | N’est pas applicable |
| Densité de vapeur | N’est pas applicable |
| pKa | N’est pas applicable |
| pH | Neutre |
Sécurité et dangers de l’azoture de sodium
Le sodiumazide présente des risques importants pour la sécurité et doit être manipulé avec la plus grande prudence. Il est hautement toxique s’il est ingéré, inhalé ou absorbé par la peau. L’exposition au sodiumazide peut entraîner de graves risques pour la santé, notamment des problèmes respiratoires, des étourdissements et même la mort. Il s’agit également d’un risque potentiel d’explosion, en particulier en cas de chaleur, de choc ou de contact avec certains métaux. Lorsqu’on travaille avec de l’azoture de sodium, les personnes doivent porter un équipement de protection individuelle approprié, notamment des gants et des lunettes de sécurité. Il est crucial de stocker et de manipuler ce composé dans des zones bien ventilées, loin des sources d’inflammation et des substances incompatibles afin de minimiser les risques d’accidents et d’assurer la sécurité du lieu de travail.
| Symboles de danger | Toxique, Explosif |
| Description de la sécurité | Manipulez avec une extrême prudence. Substance toxique et explosive. |
| Numéros d’identification de l’ONU | UN1687 (pour sodiumazide, solides toxiques, inorganiques, nsa) |
| Code SH | 28500090 |
| Classe de danger | 6.1 (Substances toxiques) |
| Groupe d’emballage | II (substance moyennement dangereuse) |
| Toxicité | Très toxique |
Méthodes de synthèse de l’azoture de sodium
Il existe quelques méthodes courantes pour synthétiser le sodiumazide.
Une méthode implique la réaction entre l’amide de sodium (NaNH2) et l’acide hydrazoïque (HN3). Dans cette méthode, dissolvez l’amidure de sodium dans de l’ammoniaque liquide, puis ajoutez lentement de l’acide hydrazoïque. La réaction a lieu, entraînant la formation d’azide de sodium et de chlorure d’ammonium comme sous-produits.
Une autre méthode de synthèse implique la réaction entre le nitrite de sodium (NaNO2) et l’azide de sodium (NaN3). Dans une solution aqueuse, la réaction contrôle soigneusement l’ajout de nitrite de sodium à une solution de sodiumazide, conduisant à la formation de sodiumazide et de nitrate de sodium.
Pour synthétiser l’azide de sodium, on peut réagir avec le cyanure de sodium (NaCN) avec le protoxyde d’azote (N2O) à haute température. Au cours de cette réaction, de l’azide de sodium et du cyanate de sodium se forment comme sous-produits.
Suivez toujours les précautions de sécurité appropriées pour minimiser les risques associés au processus de synthèse. Cela inclut l’utilisation d’un équipement de protection individuelle et le respect des protocoles de manipulation.
Utilisations de l’azoture de sodium
Le sodiumazide a plusieurs utilisations importantes dans diverses industries. Voici quelques applications notables :
- Gonflage des airbags : le sodiumazide est un composant clé des airbags automobiles. Lors d’une collision, une petite quantité de sodiumazide réagit rapidement pour générer de l’azote gazeux, gonflant l’airbag et protégeant les passagers.
- Recherche biochimique : les chercheurs utilisent le sodiumazide pour inhiber des enzymes, telles que la cytochrome oxydase, facilitant ainsi l’étude des processus cellulaires et des voies métaboliques.
- Préservation des échantillons biologiques : Le sodiumazide préserve les échantillons biologiques, tels que les anticorps, en empêchant la croissance bactérienne et en maintenant leur stabilité.
- Initiation explosive : Le sodiumazide sert d’explosif primaire dans certains dispositifs pyrotechniques, détonateurs et initiateurs d’explosifs en raison de sa nature explosive.
- Synthèse chimique : Le sodiumazide agit comme précurseur dans diverses réactions chimiques, permettant la synthèse de composés organiques, de produits pharmaceutiques et de colorants.
- Prévention de la corrosion : les industries utilisent l’azide de sodium comme inhibiteur de corrosion pour protéger les surfaces métalliques de la dégradation causée par l’oxydation ou l’exposition à des agents corrosifs.
- Industrie minière : Le sodiumazide aide à séparer les minéraux précieux des substances indésirables dans les opérations minières en tant que dépresseur dans les processus de flottation des minéraux.
- Industrie des polymères : Le sodiumazide agit comme agent gonflant dans la production de mousses de polyuréthane, facilitant la formation de bulles de gaz qui donnent à la mousse la structure souhaitée.
- Chimie analytique : le sodiumazide sert de réactif pour diverses analyses chimiques, notamment la spectrophotométrie, la chromatographie en phase gazeuse et la spectrométrie de masse.
- Médecine vétérinaire : Les vétérinaires utilisent le sodiumazide comme agent d’euthanasie pour les animaux dans certains cas dans le cadre de la pratique vétérinaire.
Ces applications mettent en évidence les diverses utilités du sodiumazide, mais il est crucial de manipuler ce composé avec soin et de respecter les protocoles de sécurité en raison de sa nature toxique et explosive.
Des questions
Q : Comment tester l’azoture de sodium ?
R : Le sodiumazide peut être testé à l’aide de techniques analytiques appropriées telles que la spectroscopie, la chromatographie ou des tests de réactivité chimique.
Q : L’azoture de sodium est-il toujours utilisé dans les airbags ?
R : Oui, le sodiumazide est toujours utilisé dans les airbags comme propulseur pour un gonflage rapide lors de l’impact.
Q : Combien de grammes d’azoture de sodium faut-il pour produire 30,5 g d’azote ?
R : Environ 34 grammes d’azide de sodium sont nécessaires pour produire 30,5 grammes d’azote gazeux.
Q : Où acheter de l’azide de sodium ?
R : Le sodiumazide peut être acheté auprès de fournisseurs de produits chimiques, de fournisseurs de laboratoires ou de marchés de produits chimiques en ligne.
Q : Comment préparer une solution d’azoture de sodium à 0,01 % dans du PBS ?
R : Pour préparer une solution de sodiumazide à 0,01 % dans du PBS, dissolvez 0,01 gramme de sodiumazide dans 100 ml de solution de PBS (Phosphate Buffered Saline).
Q : Quel est le rôle de l’azoture de sodium dans les expériences ?
R : Le sodiumazide est couramment utilisé comme inhibiteur ou conservateur dans des expériences visant à inhiber l’activité enzymatique ou à empêcher la croissance bactérienne.
Q : Comment purger l’azoture de sodium d’un échantillon ?
R : Le sodiumazide peut être purgé d’un échantillon par un lavage ou un rinçage approfondi avec des solvants appropriés ou en le soumettant à une décomposition à haute température.
Q : Comment l’azoture de sodium affecte-t-il l’ETC ?
R : Le sodiumazide inhibe la chaîne de transport d’électrons (ETC) dans les mitochondries en bloquant l’enzyme cytochrome oxydase, interrompant ainsi le flux d’électrons et la production d’ATP.
Q : Combien de grammes de sodium se forment lorsque 93 grammes d’azoture de sodium réagissent ?
R : 35,9 grammes de sodium se forment lorsque 93 grammes d’azide de sodium réagissent.
Q : La décomposition explosive de l’azoture de sodium est-elle un changement physique dans le déploiement des airbags ?
R : Non, la décomposition explosive du sodiumazide pour gonfler un airbag automobile est un changement chimique.
Q : Comment préparer l’azoture de sodium ?
R : Le sodiumazide est généralement préparé par des méthodes de synthèse chimique impliquant des réactions entre des précurseurs appropriés, tels que l’amidure de sodium et l’acide hydrazoïque.
Q : Quelle quantité d’azoture de sodium est toxique ?
R : Le sodiumazide est hautement toxique et même de petites quantités, comme quelques grammes, peuvent présenter des risques importants pour la santé en cas d’ingestion, d’inhalation ou d’absorption par la peau.
Q : À quoi sert l’azoture de sodium ?
R : Le sodiumazide est utilisé dans diverses applications, notamment le gonflage des airbags, la recherche biochimique, la synthèse chimique et comme conservateur ou inhibiteur dans les échantillons biologiques.
Q : L’azoture de sodium réagit-il avec les acides ?
R : Oui, l’azide de sodium peut réagir avec des acides, tels que l’acide chlorhydrique (HCl), formant des gaz toxiques comme l’azoture d’hydrogène (HN3). Des précautions appropriées doivent être prises lors de la manipulation du sodiumazide et des acides.
