يوديد البوتاسيوم (KI) هو مركب كيميائي يستخدم لمنع امتصاص الغدة الدرقية لليود المشع. وهو فعال عندما يؤخذ قبل أو بعد فترة قصيرة من التعرض لليود المشع.
| اسم الأيوباك | يوديد البوتاسيوم |
| الصيغة الجزيئية | كي |
| CAS رقم | 7681-11-0 |
| المرادفات | كاليوميوديد، أحادي يوديد البوتاسيوم، يوديد K، KI |
| إنتشي | InChI=1S/HI.K/h1H;/q;+1/p-1 |
خصائص يوديد البوتاسيوم
صيغة يوديد البوتاسيوم
صيغة يوديد البوتاسيوم هي KI. تمثل هذه الصيغة أبسط نسبة لذرات البوتاسيوم واليود في المركب. تُستخدم صيغة يوديد البوتاسيوم لحساب كمية المركب المطلوبة في التطبيقات المختلفة، وكذلك لتحديد وزنه الجزيئي وخصائصه الأخرى.
يوديد البوتاسيوم الكتلة المولية
KI لديه كتلة مولية تبلغ حوالي 166.0028 جم / مول. يتم حساب هذه القيمة عن طريق إضافة الأوزان الذرية لـ K وI في المركب، وهي 39.0983 جم/مول و126.9045 جم/مول، على التوالي. تعتبر الكتلة المولية لـ KI مهمة في تحديد كمية المركب المطلوبة في تفاعل أو تطبيق معين.
نقطة غليان يوديد البوتاسيوم
نقطة غليان KI هي 1330 درجة مئوية (2426 درجة فهرنهايت). ترجع نقطة الغليان العالية هذه إلى الرابطة الأيونية القوية بين ذرات البوتاسيوم واليود في المركب. يتم استخدام KI في تطبيقات درجات الحرارة المرتفعة نظرًا لقدرته على تحمل الحرارة الشديدة دون أن ينهار أو يفقد فعاليته.
نقطة انصهار يوديد البوتاسيوم
نقطة انصهار KI هي 681 درجة مئوية (1258 درجة فهرنهايت). نقطة الانصهار المنخفضة نسبيًا هذه تجعل من السهل التعامل مع KI ومعالجته في درجات حرارة معتدلة. يستخدم المركب بشكل شائع في إنتاج الأفلام الفوتوغرافية والأدوية والطب النووي بسبب نقطة انصهاره المنخفضة.
كثافة يوديد البوتاسيوم جم/مل
كثافة KI هي 3.123 جم / مل. هذه القيمة أعلى من قيمة الماء، مما يجعل KI ثقيلًا وكثيفًا نسبيًا. تعتبر كثافة KI مهمة في تحديد قابلية ذوبانه في المذيبات المختلفة وفي تطبيقاته كمادة حماية إشعاعية.
الوزن الجزيئي يوديد البوتاسيوم
يبلغ الوزن الجزيئي لـ KI حوالي 166.0028 جم / مول. تمثل هذه القيمة مجموع الأوزان الذرية للعناصر المكونة للمركب. يعد الوزن الجزيئي لـ KI مهمًا لتحديد خصائصه وحساب تركيزه في المحاليل.
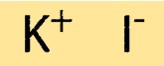
هيكل يوديد البوتاسيوم
يحتوي KI على بنية بلورية بسيطة، تتكون من ترتيب مكعب متمركز حول الوجه من أيونات K+ وأيونات I-. ترتبط الأيونات معًا بروابط أيونية قوية، مما يمنح المركب نقاط انصهار وغليان عالية. التركيب البلوري لـ KI مهم لفهم خصائصه الفيزيائية والكيميائية.
| مظهر | مسحوق بلوري أبيض |
| كثافة محددة | 3.123 |
| لون | عديم اللون إلى الأبيض |
| يشم | عديم الرائحة |
| الكتلة المولية | 166.0028 جرام/مول |
| كثافة | 3.123 جم/مل |
| نقطة الانصهار | 681 درجة مئوية (1258 درجة فهرنهايت) |
| نقطة الغليان | 1330 درجة مئوية (2426 درجة فهرنهايت) |
| نقطة فلاش | لا يمكن تطبيقه |
| الذوبان في الماء | 128 جم/100 مل (20 درجة مئوية) |
| الذوبان | قابل للذوبان في الإيثانول والأسيتون والجلسرين |
| ضغط البخار | ضئيلة |
| كثافة بخار | لا يمكن تطبيقه |
| pKa | 10.8 |
| الرقم الهيدروجيني | 6.0 – 9.0 (محلول 5%) |
سلامة ومخاطر يوديد البوتاسيوم
تعتبر KI بشكل عام آمنة عند استخدامها بشكل مناسب. ومع ذلك، مثل جميع المواد الكيميائية، يمكن أن تشكل مخاطر إذا تم التعامل معها بشكل غير لائق أو استخدامها بشكل غير مناسب. يمكن أن يؤدي KI إلى تهيج الجلد والعينين والجهاز التنفسي، وقد يؤدي التعرض لفترة طويلة إلى آثار صحية أكثر خطورة. كما أنه سام إذا تم تناوله بكميات كبيرة. يجب اتباع إجراءات المعالجة والتخزين والتخلص المناسبة عند العمل مع KI. بالإضافة إلى ذلك، يجب ارتداء معدات الحماية الشخصية، مثل القفازات وحماية العين، عند التعامل مع المجمع.
| رموز الخطر | الحادي عشر |
| وصف الأمان | تجنب استنشاق الغبار/الأبخرة/الغاز/الضباب/الأبخرة/الرذاذ. ارتداء القفازات الواقية / حماية العين / حماية الوجه. في حالة الاستنشاق: أخرج الضحية إلى الهواء النقي وابقها في وضع مريح للتنفس. إذا كان في العينين: اشطفيه بحذر بالماء لعدة دقائق. إزالة العدسات اللاصقة، إذا كانت موجودة وسهلة للقيام. استمر في الشطف. |
| أرقام تعريف الأمم المتحدة | الأمم المتحدة 3077 |
| رمز النظام المنسق | 28276000 |
| فئة الخطر | 9- المواد الخطرة المتنوعة |
| مجموعة التعبئة | ثالثا |
| تسمم | الجرعة المميتة 50 (عن طريق الفم، الفئران)> 10000 ملغم/كغم |
طرق تخليق يوديد البوتاسيوم
هناك عدة طرق لتصنيع KI، ولكن إحدى الطرق الأكثر شيوعًا تتضمن تفاعل اليود مع هيدروكسيد البوتاسيوم أو كربونات البوتاسيوم في الماء. معادلة هذا التفاعل هي:
I2 + 2KOH → KI + KIO3 + H2O
تنتج هذه العملية KI ويودات البوتاسيوم والماء كمنتجات ثانوية. تسخين الخليط يكسر يودات البوتاسيوم ويترك KI نقيًا.
هناك طريقة أخرى لتصنيع KI تتضمن تفاعل اليود مع ثاني كبريتيت البوتاسيوم في الماء. ينتج عن هذا التفاعل KI بالإضافة إلى غاز ثاني أكسيد الكبريت كمنتج ثانوي. معادلة هذا التفاعل هي:
I2 + 2KHSO3 → 2KI + 2SO2 + H2O
يمكن تنقية KI التي تم الحصول عليها عن طريق إعادة البلورة في الماء الساخن.
تحتوي الطحالب على مستويات عالية من اليود، والتي يمكن للكيميائيين استخدامها للحصول على KI. تتضمن العملية حرق الطحالب لإنتاج الرماد، وإذابة الرماد في الماء، ومعالجته بهيدروكسيد البوتاسيوم لإنتاج KI.
استخدامات يوديد البوتاسيوم
فيما يلي بعض الاستخدامات الشائعة لـ KI:
- الحماية من الإشعاع: يستخدم لحماية الغدة الدرقية من الإشعاع في حالة وقوع حادث أو هجوم نووي. وهو يعمل عن طريق تشبع الغدة الدرقية باليود غير المشع، مما يمنع امتصاص نظائر اليود المشعة.
- الأغراض الطبية: يستخدم لعلاج أمراض الغدة الدرقية مثل فرط نشاط الغدة الدرقية وتضخم الغدة الدرقية. يستخدم أيضًا كمكمل غذائي للوقاية من نقص اليود.
- التصوير الفوتوغرافي: يستخدم كمكون في المستحلبات الفوتوغرافية.
- الكيمياء التحليلية: تستخدم في الكيمياء التحليلية لتحديد تركيز العوامل المؤكسدة في العينة.
- الكيمياء العضوية: يستخدم في تفاعلات الكيمياء العضوية كمصدر لليود.
- تغذية الحيوان: يستخدم كإضافة علفية للماشية للوقاية من نقص اليود وتحسين الصحة العامة.
- كشف النشا: يستخدم ككاشف للكشف عن وجود النشا في المحاليل.
- العامل المختزل: يعمل كعامل مختزل في بعض التفاعلات الكيميائية.
أسئلة:
س: أين يمكنني شراء يوديد البوتاسيوم بالقرب مني؟
ج: يمكنك شراء KI من العديد من الصيدليات ومتاجر الأطعمة الصحية وتجار التجزئة عبر الإنترنت. غالبًا ما يتم بيعه كمكمل غذائي أو كعامل حماية من الإشعاع.
س: ما هي مجموعة العملاء التي لا ينبغي أن تتلقى يوديد البوتاسيوم؟
ج: يجب على الأشخاص الذين يعانون من أمراض معينة في الغدة الدرقية أو حساسية تجاه اليود عدم تناول KI. ومن المهم استشارة أخصائي الرعاية الصحية قبل تناول أي مكملات أو أدوية.
س: ما المحلول الذي يحتوي على 6.0 بالمائة (m/m) من يوديد البوتاسيوم (KI) في الماء؟
ج: إن محلول 6.0 بالمائة (m/m) من KI في الماء يعني أن 6.0 جرام من KI مذاب في 100 جرام من الماء.
س: ما هو يوديد البوتاسيوم؟
ج: KI هو مركب كيميائي يتكون من البوتاسيوم واليود. صيغته الكيميائية هي KI.
س: هل KI أيوني أم تساهمي؟
ج: يوديد البوتاسيوم (KI) مركب أيوني. ويتكون من التجاذب الكهروستاتيكي بين أيونات البوتاسيوم الموجبة وأيونات اليوديد سالبة الشحنة.
س: هل KI قابل للذوبان في الماء؟
ج: نعم، يوديد البوتاسيوم شديد الذوبان في الماء. في درجة حرارة الغرفة، يمكن إذابة حوالي 140 جرامًا من KI في 100 ملليلتر من الماء.
س: ما هو KI في الكيمياء؟
ج: في الكيمياء، KI هي الصيغة الكيميائية ليوديد البوتاسيوم، وهو مركب يستخدم في مجموعة متنوعة من التطبيقات بما في ذلك الحماية من الإشعاع، والأغراض الطبية، والكيمياء التحليلية.
