هيدريد الليثيوم مركب يتكون من الليثيوم والهيدروجين. وهو شديد التفاعل ويستخدم على نطاق واسع في مختلف التطبيقات بما في ذلك تخزين الطاقة والتفاعلات النووية.
| اسم الأيوباك | هيدريد الليثيوم |
| الصيغة الجزيئية | ليه |
| CAS رقم | 7580-67-8 |
| المرادفات | مونوهيدريد الليثيوم، الليثان، هيدريد الليثيوم، هيدريد الليثيوم |
| إنتشي | InChI = 1S/Li.H |
خصائص هيدريد الليثيوم
صيغة هيدريد الليثيوم
صيغة مونوهيدريد الليثيوم هي LiH. وتتكون من ذرة ليثيوم مرتبطة بذرة هيدروجين. تمثل هذه الصيغة البسيطة والموجزة التركيب العنصري لمونوهيدريد الليثيوم.
هيدريد الليثيوم الكتلة المولية
يتم حساب الكتلة المولية لمونوهيدريد الليثيوم عن طريق إضافة الكتل الذرية لليثيوم (Li) والهيدروجين (H). هذا ما يقرب من 7.95 جرام لكل مول (جم / مول). الكتلة المولية ضرورية لإجراء العديد من العمليات الحسابية في الكيمياء، مثل تحديد كمية المادة في عينة معينة.
نقطة غليان هيدريد الليثيوم
يحتوي مونوهيدريد الليثيوم على نقطة غليان عالية تبلغ حوالي 1350 درجة مئوية (2462 درجة فهرنهايت). يشير هذا إلى أن هناك حاجة إلى كمية كبيرة من الطاقة لتحويل المركب الصلب إلى الحالة الغازية.
نقطة انصهار هيدريد الليثيوم
نقطة انصهار مونوهيدريد الليثيوم عالية جدًا، عند حوالي 688 درجة مئوية (1270 درجة فهرنهايت). تمثل درجة الحرارة هذه النقطة التي يتحول عندها المركب الصلب إلى الحالة السائلة عند التسخين.
كثافة هيدريد الليثيوم جم / مل
تبلغ كثافة مونوهيدريد الليثيوم حوالي 0.82 جرام لكل مليلتر (جم / مل). تشير هذه القيمة إلى أن مونوهيدريد الليثيوم مركب كثيف نسبيًا، مما يعني أنه يحتوي على كتلة كبيرة لكل وحدة حجم.
الوزن الجزيئي لهيدريد الليثيوم
يتم تحديد الوزن الجزيئي لمونوهيدريد الليثيوم عن طريق إضافة الأوزان الذرية لليثيوم والهيدروجين. هذا ما يقرب من 7.95 جرام لكل مول (جم / مول). الوزن الجزيئي أمر بالغ الأهمية في الحسابات الكيميائية المختلفة، وخاصة في تحديد العناصر الكيميائية للتفاعلات.
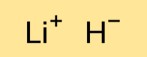
هيكل هيدريد الليثيوم
يحتوي مونوهيدريد الليثيوم على بنية بلورية يتم فيها ترتيب كاتيونات الليثيوم (Li+) وأنيونات الهيدريد (H-) في شبكة ثلاثية الأبعاد. ترتبط ذرات الليثيوم والهيدروجين معًا بروابط أيونية قوية.
ذوبان هيدريد الليثيوم
مونوهيدريد الليثيوم ضعيف الذوبان في الماء. يتفاعل مع الماء لتكوين هيدروكسيد الليثيوم (LiOH) وغاز الهيدروجين (H2). ترجع هذه القابلية المحدودة للذوبان إلى الطبيعة الأيونية العالية لمونوهيدريد الليثيوم، مما يجعله أقل عرضة للذوبان في المذيبات القطبية مثل الماء.
| مظهر | الصلبة البيضاء |
| جاذبية معينة | 0.82 |
| لون | أبيض |
| يشم | عديم الرائحة |
| الكتلة المولية | 7.95 جرام/مول |
| كثافة | 0.82 جرام/مل |
| نقطة الانصهار | 688 درجة مئوية (1270 درجة فهرنهايت) |
| نقطة الغليان | 1350 درجة مئوية (2462 درجة فهرنهايت) |
| نقطة فلاش | غير قابل للتطبيق |
| الذوبان في الماء | يتفاعل مع الماء لتكوين هيدروكسيد الليثيوم (LiOH) وغاز الهيدروجين (H2). |
| الذوبان | ضعيف الذوبان |
| ضغط البخار | غير قابل للتطبيق |
| كثافة بخار | غير قابل للتطبيق |
| pKa | غير قابل للتطبيق |
| الرقم الهيدروجيني | غير قابل للتطبيق |
سلامة ومخاطر هيدريد الليثيوم
يشكل مونوهيدريد الليثيوم العديد من مخاطر السلامة. يتفاعل بعنف مع الماء، ويطلق غاز الهيدروجين القابل للاشتعال وينتج هيدروكسيد الليثيوم المسببة للتآكل. قد يؤدي الاتصال بالرطوبة أو الهواء إلى تكوين غاز الهيدروجين شديد الاشتعال. ويجب التعامل معه بحذر شديد لتجنب الاشتعال أو الانفجار العرضي. كما أن المركب شديد التفاعل مع الأحماض، ويطلق غاز الهيدروجين السام. يمكن أن يسبب مونوهيدريد الليثيوم تهيجًا خطيرًا للجلد والعينين، كما أن استنشاق غباره أو أبخرته يمكن أن يسبب ضيقًا في التنفس. يجب ارتداء معدات الحماية المناسبة، مثل القفازات والنظارات الواقية، عند العمل مع مونوهيدريد الليثيوم ويجب تخزينها في منطقة جافة وجيدة التهوية.
| رموز الخطر | قابلة للاشتعال والتآكل |
| وصف الأمان | رد الفعل للغاية وقابلة للاشتعال. تعامل بحذر شديد. تجنب ملامسة الماء والهواء والأحماض. |
| أرقام تعريف الأمم المتحدة | الأمم المتحدة 1414 |
| رمز النظام المنسق | 2850.00.10 |
| فئة الخطر | 4.3 (خطير عندما يكون مبللاً) |
| مجموعة التعبئة | أنا (خطر عظيم) |
| تسمم | سامة عن طريق الابتلاع أو الاستنشاق. قد يسبب تهيجًا خطيرًا في الجلد والعين. |
طرق تصنيع هيدريد الليثيوم
يمكن استخدام طرق مختلفة لتجميع مونوهيدريد الليثيوم.
تتضمن الطريقة الشائعة الجمع المباشر بين الليثيوم المعدني وغاز الهيدروجين. يحدث التفاعل عند درجات حرارة عالية، عادة ما تكون أعلى من 600 درجة مئوية (1112 درجة فهرنهايت)، في بيئة خاضعة للرقابة. يتفاعل معدن الليثيوم مع غاز الهيدروجين لتكوين مونوهيدريد الليثيوم.
هناك طريقة أخرى وهي اختزال أميد الليثيوم (LiNH2) بمعدن الليثيوم. يحدث هذا التفاعل عند درجات حرارة منخفضة، حوالي 350 إلى 400 درجة مئوية (662 إلى 752 درجة فهرنهايت). تفاعل أميد الليثيوم مع فلز الليثيوم ينتج مونوهيدريد الليثيوم.
يمكن أن يتم تخليق مونوهيدريد الليثيوم أيضًا عن طريق الجمع بين بوروهيدريد الليثيوم (LiBH4) مع مونوهيدريد الليثيوم نفسه. ويحدث التفاعل عند درجات حرارة عالية، عادة حوالي 400 درجة مئوية (752 درجة فهرنهايت). تسمح هذه الطريقة بتكوين مونوهيدريد الليثيوم من بوروهيدريد الليثيوم المتوفر بسهولة.
بالإضافة إلى ذلك، يعمل هيدريد ألومنيوم الليثيوم (LiAlH4) كمادة خام لتخليق مونوهيدريد الليثيوم. في ظل ظروف خاضعة للرقابة، يتفاعل هيدريد ألومنيوم الليثيوم مع معدن الليثيوم، مما يؤدي إلى تكوين مونوهيدريد الليثيوم.
تجدر الإشارة إلى أن هذه الأساليب تتطلب معالجة دقيقة ورقابة صارمة على ظروف التفاعل بسبب الطبيعة شديدة التفاعل لمونوهيدريد الليثيوم. وينبغي اتباع احتياطات السلامة، مثل العمل في جو خامل واستخدام معدات الحماية المناسبة، أثناء عملية التوليف.
استخدامات هيدريد الليثيوم
يجد مونوهيدريد الليثيوم تطبيقات مختلفة بسبب خصائصه الفريدة وتفاعله. وهذه بعض استخداماته:
- يتيح مونوهيدريد الليثيوم تطوير أنظمة تخزين الهيدروجين المتقدمة، مما يسهل حلول تخزين الطاقة الفعالة والمدمجة.
- وفي التفاعلات النووية، يعمل كمصدر للنيوترونات ويجد تطبيقات في مرافق البحوث ومحطات الطاقة النووية.
- يستخدم التخليق العضوي أحادي هيدريد الليثيوم كعامل اختزال قوي لتقليل المجموعات الوظيفية المختلفة.
- فهو يولد غاز الهيدروجين من خلال تفاعله مع الماء أو الأحماض، مما يجعله ذو قيمة لإنتاج الهيدروجين في الموقع.
- عند دمجه مع أنواع الوقود الدافعة الأخرى، يساهم مونوهيدريد الليثيوم في إنتاج الطاقة ودفع محركات الصواريخ.
- ويلعب مونوهيدريد الليثيوم دورًا في إنتاج غاز الديوتيريوم، الذي له تطبيقات في توليد الطاقة النووية والبحث العلمي.
- تستخدم العمليات الميتالورجية المائية أحادي هيدريد الليثيوم لإنتاج معادن مختلفة مثل التيتانيوم والزركونيوم.
- وهو بمثابة مقدمة أو كاشف في التركيب الكيميائي، والمساهمة في تكوين المركبات العضوية وغير العضوية.
- تستخدم بعض تركيبات الألعاب النارية مونوهيدريد الليثيوم لتوليد حرارة وغازات شديدة أثناء التفاعل.
- تستخدم تفاعلات الهدرجة أحادي هيدريد الليثيوم لإضافة الهيدروجين إلى المركبات غير المشبعة، وبالتالي تكوين مركبات مشبعة.
تسلط هذه التطبيقات المتنوعة الضوء على تنوع وأهمية مونوهيدريد الليثيوم في العديد من الصناعات والمساعي العلمية.
أسئلة:
س: ما صيغة الهيدريد الناتج عن الليثيوم؟
ج: صيغة مونوهيدريد المكون من الليثيوم هي LiH.
س: هل يقلل هيدريد الليثيوم من الروابط المزدوجة؟
ج: نعم، يمكن لمونوهيدريد الليثيوم تقليل الروابط المزدوجة في المركبات العضوية.
س: ماذا يقلل هيدريد الليثيوم؟
ج: LiH هو عامل اختزال قوي يستخدم بشكل شائع لتقليل المجموعات الوظيفية المختلفة في التخليق العضوي.
س: هل هيدريد الليثيوم أيوني أم تساهمي؟
ج: مونوهيدريد الليثيوم هو مركب أيوني يتكون من كاتيونات Li+ وأنيونات H-.
س: ما الفرق بين بطاريات الليثيوم أيون وبطاريات هيدريد معدن النيكل؟
ج: توفر بطاريات Li-ion كثافة طاقة أعلى وعمرًا أطول ووزنًا أخف من بطاريات هيدريد معدن النيكل.
س: ما هي آلية هيدريد الليثيوم؟
ج: تختلف آلية مونوهيدريد الليثيوم اعتمادًا على تفاعله وتطبيقه المحدد. يمكن أن يعمل كعامل اختزال أو يتفاعل مع الماء أو الأحماض أو المركبات الأخرى.
س: هل هيدريد الليثيوم محب للنواة؟
ج: نعم، يمكن أن يعمل مونوهيدريد الليثيوم كنوكليوفيل في بعض التفاعلات الكيميائية.
س: ما هي العناصر التي يصنعها هيدريد الليثيوم؟
ج: يستخدم مونوهيدريد الليثيوم بشكل أساسي في التطبيقات الصناعية، مثل أنظمة تخزين الطاقة، والتفاعلات النووية، وإنتاج الهيدروجين، والتخليق الكيميائي.
س: هل يقلل هيدريد الليثيوم من الكحوليات؟
ج: يمكن لمونوهيدريد الليثيوم أن يختزل الكحولات إلى الألكانات أو الألدهيدات المقابلة لها اعتمادًا على ظروف التفاعل وعوامل أخرى.
