هيدروكسيد النيكل (Ni(OH)2) هو مركب كيميائي يتكون من أيونات النيكل والهيدروكسيد. يستخدم عادة كمقدمة للبطاريات القائمة على النيكل.
| اسم الأيوباك | هيدروكسيد النيكل |
| الصيغة الجزيئية | ني (أوه)2 |
| CAS رقم | 12054-48-7 |
| المرادفات | هيدروكسيد النيكل (II)؛ هيدروكسيد النيكل؛ ثالث أكسيد النيكل والنيتروجين (2+) |
| إنتشي | InChI=1S/Ni.2H2O/h;2*1H2/q+2;;/p-2 |
خصائص هيدروكسيد النيكل
صيغة هيدروكسيد النيكل
صيغة هيدروكسيد النيكل هي Ni(OH)2. وهو يتألف من أيون نيكل واحد (Ni) وأيوني هيدروكسيد (OH-). تمثل هذه الصيغة الكيميائية تركيبة هيدروكسيد النيكل على المستوى الذري.
هيدروكسيد النيكل الكتلة المولية
يتم حساب الكتلة المولية لـ Ni(OH)2 عن طريق إضافة الكتل الذرية للعناصر المكونة لها. تبلغ الكتلة الذرية للنيكل 58.6934 جم/مول، وكتلة كل أيون هيدروكسيد 17.007 جم/مول. وبجمعها، تبلغ الكتلة المولية لـ Ni(OH)2 حوالي 92.6934 جم/مول.
نقطة غليان هيدروكسيد النيكل
ليس لدى Ni(OH)2 نقطة غليان محددة جيدًا لأنه يتحلل عند تسخينه. عند درجات الحرارة المرتفعة يتعرض للتحلل الحراري ويتحول إلى أكسيد النيكل (NiO) وبخار الماء.
نقطة انصهار هيدروكسيد النيكل
تبلغ نقطة انصهار Ni(OH)2 حوالي 230 درجة مئوية. عند درجة الحرارة هذه، يخضع Ni(OH)2 لتغير في الطور من الحالة الصلبة إلى الحالة السائلة. يذوب المركب، مما يسمح بمزيد من التفاعلات أو المعالجات الكيميائية.
كثافة هيدروكسيد النيكل جم/مل
تبلغ كثافة Ni(OH)2 حوالي 4.1 جم/مل. تمثل هذه القيمة كتلة المركب لكل وحدة حجم. إنه يشير إلى ضغط أو تركيز Ni(OH)2 في مساحة معينة.
الوزن الجزيئي لهيدروكسيد النيكل
يتم تحديد الوزن الجزيئي لـ Ni(OH)2 عن طريق إضافة الأوزان الذرية للعناصر المكونة له. يبلغ الوزن الذري للنيكل 58.6934 جم/مول، ويزن كل أيون هيدروكسيد 17.007 جم/مول. وبالتالي، فإن الوزن الجزيئي لـ Ni(OH)2 يبلغ حوالي 92.6934 جم/مول.
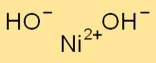
هيكل هيدروكسيد النيكل
يتبلور Ni(OH)2 في النظام البلوري السداسي. إنها تشكل طبقات من أيونات Ni+2 وOH- مكدسة فوق بعضها البعض. تُحاط أيونات Ni+2 بأيونات OH- بطريقة منسقة، مما يؤدي إلى إنشاء بنية شبكية.
ذوبان هيدروكسيد النيكل
Ni(OH)2 قليل الذوبان في الماء. يذوب إلى حد ما، ويشكل محلول قلوي قليلاً بسبب وجود أيونات الهيدروكسيد. يمكن أن تتأثر قابلية ذوبان Ni(OH)2 بعوامل مثل درجة الحرارة ودرجة الحموضة.
| مظهر | أخضر سادة |
| جاذبية معينة | 4.1 جرام/مل |
| لون | أخضر |
| يشم | عديم الرائحة |
| الكتلة المولية | 92.6934 جم/مول |
| كثافة | 4.1 جرام/مل |
| نقطة الانصهار | 230 درجة مئوية |
| نقطة الغليان | متحللة |
| نقطة فلاش | لا يوجد |
| الذوبان في الماء | قابل للذوبان قليلا |
| الذوبان | غير قابلة للذوبان، تشكل محلول قلوي في الماء |
| ضغط البخار | لا يوجد |
| كثافة بخار | لا يوجد |
| pKa | لا يوجد |
| الرقم الهيدروجيني | قلوية |
سلامة ومخاطر هيدروكسيد النيكل
يشكل Ni(OH)2 بعض مخاطر السلامة التي يجب أخذها في الاعتبار. قد يهيج الجلد والعينين والجهاز التنفسي عن طريق الاتصال أو الاستنشاق. التعرض لفترات طويلة أو متكررة قد يؤدي إلى حساسية، مما يسبب الحساسية. من المهم التعامل مع Ni(OH)2 بعناية، باستخدام تدابير الحماية المناسبة مثل القفازات والنظارات الواقية وجهاز التنفس الصناعي. في حالة حدوث ابتلاع أو التعرض العرضي، يجب طلب العناية الطبية الفورية. بالإضافة إلى ذلك، يعتبر Ni(OH)2 خطرًا بيئيًا ويجب التخلص منه بشكل صحيح وفقًا للوائح لمنع تلوث التربة أو مصادر المياه.
| رموز الخطر | لا أحد |
| وصف الأمان | – قد يسبب تهيج الجلد والعين\n- قد يسبب تهيج الجهاز التنفسي\n- احتمالية حدوث حساسية\n- اتبع إجراءات التعامل والتخلص المناسبة |
| أرقام تعريف الأمم المتحدة | غير قابل للتطبيق |
| رمز النظام المنسق | 2825.70.10 |
| فئة الخطر | لا تصنف على أنها خطيرة |
| مجموعة التعبئة | غير قابل للتطبيق |
| تسمم | تعتبر سمية منخفضة إلى متوسطة |
يرجى ملاحظة أن رموز الخطر ومعرفات الأمم المتحدة لا تنطبق على Ni(OH)2 لأنها غير مصنفة على أنها مادة خطرة. يسلط وصف السلامة المقدم الضوء على المخاطر والاحتياطات المحتملة المرتبطة بالتعامل مع Ni(OH)2. تعتبر سمية Ni(OH)2 بشكل عام منخفضة إلى متوسطة.
طرق تصنيع هيدروكسيد النيكل
هناك العديد من الطرق الاصطناعية المتاحة لإنتاج Ni(OH)2. تتضمن الطريقة الشائعة التفاعل بين ملح النيكل القابل للذوبان، مثل كبريتات النيكل أو نترات النيكل، وهيدروكسيد قلوي، عادة هيدروكسيد الصوديوم أو هيدروكسيد البوتاسيوم. يحدث التفاعل في محلول مائي تحت ظروف خاضعة للرقابة، مما يؤدي إلى تكوين Ni(OH)2 على شكل راسب.
في طريقة الترسيب الكهروكيميائي، تستخدم الخلية الإلكتروليتية النيكل المعدني كقطب كهربائي. إنه يطبق تيارًا كهربائيًا مناسبًا لتقليل أيونات النيكل من المنحل بالكهرباء وترسيبها على القطب على شكل Ni(OH)2. تسمح هذه الطريقة بالتحكم الدقيق في تكوين وتشكل Ni(OH)2 الناتج.
يسمح التحلل الحراري لأملاح النيكل بإنتاج Ni(OH)2. عن طريق تسخين ملح النيكل، مثل كربونات النيكل أو Ni(OH)2 نفسه، في بيئة خاضعة للرقابة، يخضع المركب للتحلل، وينتج Ni(OH)2 بالإضافة إلى منتجات ثانوية أخرى.
ومن الجدير بالذكر أن اختيار طريقة التوليف يعتمد على عوامل مثل النقاء المطلوب، وحجم الجسيمات، ومتطلبات التطبيق المحددة. عند اختيار الطريق الاصطناعي المناسب لإنتاج Ni(OH)2، يجب على المرء أن ينظر بعناية في النتيجة المرجوة بسبب المزايا والقيود المرتبطة بكل طريقة.
استخدامات هيدروكسيد النيكل
يجد Ni(OH)2 العديد من التطبيقات نظرًا لخصائصه الفريدة. فيما يلي بعض الاستخدامات الشائعة لـ Ni(OH)2:
- تصنيع البطاريات: يلعب Ni(OH)2 دورًا حاسمًا كمادة كاثود في البطاريات القائمة على النيكل، مثل بطاريات النيكل والكادميوم (NiCd) وبطاريات هيدريد معدن النيكل (NiMH). يقوم بتخزين وإطلاق الطاقة الكهربائية، مما يتيح تخزين الطاقة بكفاءة.
- المحفز: يعمل Ni(OH)2 كمحفز في التفاعلات الكيميائية المختلفة، بما في ذلك عمليات الهدرجة والأكسدة. خصائصه التحفيزية تسهل التحويل الفعال للمواد المتفاعلة إلى المنتجات المطلوبة.
- الطلاء الكهربائي: يشكل Ni(OH)2 طبقة نيكل ثابتة وملتصقة، مما يجعلها ذات قيمة في تطبيقات الطلاء الكهربائي. إنه يوفر طلاءًا وقائيًا ومقاومًا للتآكل وجذابًا من الناحية الجمالية على الأسطح المعدنية المختلفة.
- الأصباغ: يستخدم المصنعون Ni(OH)2 كصبغة خضراء في إنتاج السيراميك والزجاج والبلاستيك. ويعزز لونها الأخضر النابض بالحياة القيمة الجمالية لهذه المواد.
- أجهزة استشعار الغاز: تقوم أجهزة الاستشعار المعتمدة على Ni(OH)2 باكتشاف ومراقبة الغازات مثل الهيدروجين والأمونيا وكبريتيد الهيدروجين. تتيح التغييرات في التوصيل الكهربائي في أفلام Ni(OH)2 الكشف الفعال عن هذه الغازات.
- معالجة المياه: يساعد Ni(OH)2 في عمليات معالجة المياه عن طريق امتصاص وإزالة الملوثات المعدنية الثقيلة بشكل انتقائي، مثل الرصاص والكادميوم. إنه يظهر انجذابًا لهذه المعادن، مما يجعله مفيدًا لإزالتها من مصادر المياه.
- التطبيقات الصيدلانية: يتم استخدام Ni(OH)2 في التركيبات الصيدلانية، حيث يعمل كمواد رابطة أو مفككة أو منظم للأس الهيدروجيني في تركيبات الأقراص أو الكبسولات.
هذه مجرد أمثلة قليلة على التطبيقات المتنوعة لـ Ni(OH)2، مما يدل على تنوعه وأهميته في مختلف الصناعات.
أسئلة:
س: ما الصيغة الكيميائية لهيدروكسيد النيكل (II) الأساسي؟
ج: الصيغة الكيميائية لهيدروكسيد النيكل (II) هي Ni(OH)2.
س: هل هيدروكسيد النيكل قابل للذوبان في الماء؟
ج: Ni(OH)2 غير قابل للذوبان في الماء.
س: ما عدد جرامات كلوريد النيكل الثنائي اللازمة لتحييد 75.0 مل من 0.555 م من هيدروكسيد الليثيوم؟
ج: يمكن حساب جرامات كلوريد النيكل المطلوبة باستخدام قياس العناصر الكيميائية والمولارية لمحلول هيدروكسيد الليثيوم.
س: ما الشحنة التي يمثلها Ni(OH)2؟
ج: شحنة Ni(OH)2 متعادلة أو صفر.
س: كيف يتم حساب الذوبان المولي لـ Ni(OH)2؟
ج: يمكن تحديد الذوبان المولي لـ Ni(OH)2 بقسمة عدد مولات المركب المذاب على حجم المحلول.
س: ما هو الشكل المتوازن للمعادلة NaOH(aq) + NiCl2(aq) → NaCl(aq) + Ni(OH)2(s)؟
ج: المعادلة المتوازنة هي 2NaOH(aq) + NiCl2(aq) → 2NaCl(aq) + Ni(OH)2(s).
س: كم جرامًا لكل مول يحتوي على Ni(OH)2؟
ج: تبلغ الكتلة المولية لـ Ni(OH)2 حوالي 92.6934 جم/مول.
س: هل Ni(OH)2 قابل للذوبان في الماء؟
ج: لا، Ni(OH)2 غير قابل للذوبان في الماء.
س: ما هو عامل الاختزال في التفاعل: Mg + NiO2 + 2H2O → Mg(OH)2 + Ni(OH)2؟
ج: العامل المختزل في التفاعل هو المغنيسيوم (Mg).
س: هل Ni(OH)2 مادة صلبة؟
ج: نعم، Ni(OH)2 مركب صلب.
س: إذا كان جهد الخلية 0.247 فولت عند 25 درجة مئوية، فما هو Ksp لـ Ni(OH)2؟
ج: يمكن تحديد Ksp لـ Ni(OH)2 باستخدام معادلة Nernst وإمكانات الخلية.
س: ما هي الأملاح التي تكون أكثر قابلية للذوبان في المحلول الحمضي منها في الماء النقي؟
ج: الأملاح مثل Ni(OH)2 ستكون أكثر قابلية للذوبان في المحلول الحمضي بسبب تفاعل التعادل مع الحمض.
