نتريت البوتاسيوم (KNO2) هو مركب كيميائي يستخدم عادة كمادة حافظة للأغذية. ومن المعروف أنه يمنع نمو البكتيريا ويمنع تلف اللحوم وغيرها من الأطعمة.
| اسم الأيوباك | نتريت البوتاسيوم |
| الصيغة الجزيئية | كنو2 |
| CAS رقم | 7758-09-0 |
| المرادفات | حمض النيتروز، ملح البوتاسيوم. الملح الصخري (III) ؛ حمض النتريك، مركب. مع ملح البوتاسيوم (1:1)؛ إي 249 |
| إنتشي | InChI=1S/K.NO2/c;2-1-3/q+1;-1 |
خصائص نتريت البوتاسيوم
صيغة نتريت البوتاسيوم
الصيغة الكيميائية لنتريت البوتاسيوم هي KNO2. ويمثل تكوين المركب من حيث الذرات المكونة له. يتم استخدام صيغة نتريت البوتاسيوم لحساب كتلته المولية ووزنه الجزيئي.
نتريت البوتاسيوم الكتلة المولية
الكتلة المولية لـ KNO2 هي 85.103 جم/مول. وهو مشتق من مجموع الكتل الذرية للبوتاسيوم (39.10 جم / مول) والنيتروجين (14.01 جم / مول) وذرتي أكسجين (2 × 16.00 جم / مول). تعد الكتلة المولية لـ KNO2 ضرورية لتحديد كمية المادة الموجودة في كتلة أو حجم معين.
نقطة غليان نتريت البوتاسيوم
نقطة غليان KNO2 هي 320 درجة مئوية (608 درجة فهرنهايت). عند درجة الحرارة هذه، يتغير المركب من الطور السائل إلى الطور الغازي. تعتمد نقطة غليان KNO2 على عوامل مختلفة، مثل الضغط والنقاء.
نقطة انصهار نتريت البوتاسيوم
نقطة انصهار KNO2 هي 441 درجة مئوية (826 درجة فهرنهايت). عند درجة الحرارة هذه، يتحول المركب الصلب إلى الطور السائل. تعتبر نقطة انصهار KNO2 معلمة حاسمة في تحديد مدى ملاءمتها لمختلف التطبيقات، مثل حفظ الأغذية والطب.
كثافة نتريت البوتاسيوم جم/مل
تبلغ كثافة KNO2 1.915 جم / مل عند درجة حرارة الغرفة. يتم تعريف كثافة المادة على أنها كتلة المادة لكل وحدة حجم. تلعب كثافة KNO2 دورًا مهمًا في تحديد خصائصه الفيزيائية، مثل قابليته للذوبان والتفاعل الكيميائي.
الوزن الجزيئي لنترات البوتاسيوم
الوزن الجزيئي لـ KNO2 هو 85.103 جم / مول. إنها معلمة حاسمة لتحديد قياس العناصر الكيميائية للتفاعل الذي يتضمن KNO2. يستخدم الوزن الجزيئي لـ KNO2 أيضًا لتحديد خواصه الفيزيائية والكيميائية.
هيكل نتريت البوتاسيوم
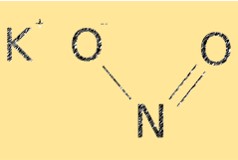
يحتوي KNO2 على الصيغة الجزيئية لـ KNO2. له بنية أيونية، مع كاتيونات البوتاسيوم (K+) وأنيونات النتريت (NO2-). يمتلك أيون النتريت هندسة جزيئية منحنية، بزاوية رابطة تبلغ حوالي 115 درجة. يعد هيكل KNO2 ضروريًا لتحديد خواصه الكيميائية، مثل قابليته للذوبان والتفاعل.
ذوبان نتريت البوتاسيوم
KNO2 قابل للذوبان بشدة في الماء، مع قابلية ذوبان تبلغ حوالي 710 جم / لتر عند 20 درجة مئوية. تعتمد قابلية ذوبان KNO2 على عوامل مختلفة مثل درجة الحرارة والضغط ووجود مواد أخرى. تعد قابلية ذوبان KNO2 عاملاً حاسماً في تحديد مدى ملاءمته لمختلف التطبيقات، مثل حفظ الأغذية والطب.
| مظهر | مادة صلبة بلورية بيضاء إلى صفراء |
| جاذبية معينة | 1,915 |
| لون | عديم اللون إلى الأبيض |
| يشم | عديم الرائحة |
| الكتلة المولية | 85.103 جرام/مول |
| كثافة | 1.915 جم/مل |
| نقطة الانصهار | 441 درجة مئوية (826 درجة فهرنهايت) |
| نقطة الغليان | 320 درجة مئوية (608 درجة فهرنهايت) |
| نقطة فلاش | غير قابل للتطبيق |
| الذوبان في الماء | شديد الذوبان (710 جم/لتر عند 20 درجة مئوية) |
| الذوبان | قابل للذوبان في الإيثانول، قابل للذوبان بشكل طفيف في الأمونيا |
| ضغط البخار | 0.0038 ملم زئبق عند 25 درجة مئوية |
| كثافة بخار | 2.96 (الهواء = 1) |
| pKa | 3.35 |
| الرقم الهيدروجيني | 5-8 (محلول 5%) |
سلامة ومخاطر نتريت البوتاسيوم
يمكن أن يكون KNO2 خطيرًا إذا تم التعامل معه بشكل غير صحيح. وهو ضار في حالة ابتلاعه أو استنشاقه وقد يسبب تهيجًا للعين والجلد والجهاز التنفسي. التعرض الطويل أو المتكرر لـ KNO2 يمكن أن يسبب ميتهيموغلوبينية الدم، وهي حالة تقلل من قدرة الدم على حمل الأكسجين. KNO2 هو أيضًا عامل مؤكسد قوي ويمكن أن يتفاعل بعنف مع المواد القابلة للاحتراق، مما يتسبب في نشوب حريق أو انفجار. وينبغي اتباع تدابير السلامة المناسبة، مثل استخدام معدات الحماية والتهوية الكافية والتخزين الآمن، عند التعامل مع KNO2. في حالة ابتلاعها أو استنشاقها، اطلب العناية الطبية على الفور.
| رموز الخطر | Xn |
| وصف الأمان | س22، س24/25 |
| أرقام تعريف الأمم المتحدة | الأمم المتحدة 1488 |
| رمز النظام المنسق | 2834.29.10 |
| فئة الخطر | 5.1 |
| مجموعة التعبئة | ثالثا |
| تسمم | ضار إذا تم ابتلاعه أو استنشاقه، قد يسبب ميتهيموغلوبينية الدم |
طرق تصنيع نتريت البوتاسيوم
يتفاعل هيدروكسيد البوتاسيوم (KOH) مع حمض النيتروز (HNO2) لتكوين KNO2. ينتج عن التفاعل KNO2 والماء (H2O) كمنتجات ثانوية. تستخدم الصناعة عادة هذه الطريقة لتصنيع كميات كبيرة من KNO2.
معادلة التفاعل هي :
2 كوه + HNO2 → KNO2 + 2 H2O
هناك طريقة أخرى لتصنيع KNO2 وهي تفاعل كربونات البوتاسيوم (K2CO3) مع أكسيد النيتريك (NO). ينتج عن التفاعل KNO2 وثاني أكسيد الكربون (CO2) والنيتروجين (N2) كمنتجات ثانوية. يعد الحصول على أكسيد النيتريك أمرًا صعبًا ومكلفًا، مما يجعل هذه الطريقة أقل استخدامًا.
معادلة التفاعل هي :
2 K2CO3 + 2 NO → 2 KNO2 + 2 CO2 + N2
يمكن الحصول على KNO2 عن طريق أكسدة KNO3 باستخدام عامل اختزال مثل SO2 أو FeSO4.
ينتج عن التفاعل KNO2 والماء والشكل المخفض لعامل الاختزال كمنتجات ثانوية. يستخدم العلماء هذه الطريقة بشكل أقل تكرارًا ويحتفظون بها بشكل عام للتوليفات المعملية على نطاق صغير.
معادلة التفاعل مع ثاني أكسيد الكبريت هي:
2 KNO3 + 3 SO2 + H2O → 2 KNO2 + 3 H2SO4
استخدامات نتريت البوتاسيوم
لدى KNO2 العديد من التطبيقات الصناعية والمخبرية بسبب خصائصه الكيميائية. بعض الاستخدامات الشائعة لـ KNO2 هي:
- حفظ الأغذية: يستخدم كمادة حافظة في اللحوم المعالجة لمنع نمو البكتيريا الضارة وإطالة مدة صلاحيتها.
- الصناعة الكيميائية: تستخدم كوسيط في إنتاج العديد من المواد الكيميائية، مثل حمض النيتروز، ومركبات الديازونيوم، والنتريت العضوي.
- الزراعة: يستخدم كسماد ومحسن للتربة بسبب قابليته العالية للذوبان في الماء وقدرته على إطلاق النيتروجين.
- الكاشف المعملي: يستخدم ككاشف في العديد من التطبيقات المخبرية، مثل الكشف عن الأمينات الأولية وتحضير أملاح الديازونيوم.
- الاستخدام الطبي: يستخدم في علاج التسمم بالسيانيد لأنه يتفاعل مع أيونات السيانيد لتكوين السيانميثيموجلوبين غير السام.
- التصوير الفوتوغرافي: يستخدم كإضافة في مطوري التصوير الفوتوغرافي لتحسين جودة ووضوح الصور المطورة.
- صناعة الزجاج: يستخدم في صناعة الزجاج كعامل تبييض لإزالة الألوان غير المرغوب فيها من المنتجات الزجاجية.
أسئلة:
ما هو نتريت البوتاسيوم؟
ج: KNO2 هو مركب غير عضوي يستخدم عادة في مختلف التطبيقات الصناعية والمخبرية.
س: ما هي صيغة نتريت البوتاسيوم؟
ج: الصيغة الكيميائية لنتريت البوتاسيوم هي KNO2.
س: ما الملح الذي ينتج عندما يتفاعل NH4OH مع HNO3؟ KNO2 أو NaNO3 أو NH4NO3 أو NH4NO2؟
ج: عندما يتفاعل NH4OH مع HNO3، فإن الملح الناتج هو NH4NO3.
س: هل KNO2 حمض أم قاعدة؟
ج: KNO2 مركب أساسي.
س: ما اسم المركب الذي صيغته KNO2؟
ج: اسم المركب الذي صيغته KNO2 هو نتريت البوتاسيوم.
س: هل KNO2 قاعدة ضعيفة؟
ج: يعتبر KNO2 قاعدة ضعيفة.
س: هل KNO2 حمضي أم أساسي؟
ج: يعتبر KNO2 أساسيًا بطبيعته ويمكن أن يعمل كعامل اختزال خفيف.
