نترات النحاس (Cu(NO3)2) هو مركب بلوري أزرق يستخدم في مختلف الصناعات. إنه بمثابة محفز وعامل مؤكسد ومقدمة للمواد النحاسية في العمليات الكيميائية.
| اسم الأيوباك | نترات النحاس الثنائي |
| الصيغة الجزيئية | النحاس (NO3)2 |
| CAS رقم | 3251-23-8 |
| المرادفات | نترات النحاسيك نترات النحاس؛ نترات النحاس؛ حمض النيتريك، ملح النحاس (2+) |
| إنتشي | InChI=1S/2NO3.Cu/c2 2-1(3)4;/q2 -1;+2 |
خصائص نترات النحاس
صيغة نترات النحاس
الصيغة الكيميائية لنترات النحاسيك هي Cu(NO3)2. يشير هذا إلى أن كل جزيء من نترات النحاس يحتوي على أيون نحاس واحد (Cu) وأيوني نترات (NO3). يشير وجود أيونات النحاس (II) إلى حالة أكسدة النحاس +2.
نترات النحاس الكتلة المولية
يمكن حساب الكتلة المولية لنترات النحاسيك عن طريق إضافة الكتل الذرية للعناصر المكونة لها. يحتوي النحاس (Cu) على كتلة مولية تبلغ حوالي 63.55 جم / مول، بينما تبلغ الكتلة المولية للنترات (NO3) حوالي 62.00 جم / مول. لذا، تبلغ الكتلة المولية لنترات النحاس حوالي 187.55 جم/مول.
درجة غليان نترات النحاس
تشير نقطة غليان نترات النحاسيك إلى درجة الحرارة التي يتحول عندها من سائل إلى غاز تحت الضغط الجوي القياسي. تكون نقطة غليان نترات النحاس بشكل عام أعلى من 100 درجة مئوية (212 درجة فهرنهايت). ومع ذلك، فمن المهم ملاحظة أن نترات النحاسيك تتحلل بشكل عام قبل أن تصل إلى نقطة الغليان.
نقطة انصهار نترات النحاس
نقطة انصهار نترات النحاس هي درجة الحرارة التي يتحول عندها من الحالة الصلبة إلى الحالة السائلة. تتراوح نقطة انصهار نترات النحاس عمومًا بين 256 درجة مئوية و260 درجة مئوية (493 درجة فهرنهايت و500 درجة فهرنهايت). ومن الضروري التعامل مع هذه المادة بعناية لتجنب تحللها.
كثافة نترات النحاس جم/مل
تشير كثافة نترات النحاسيك إلى كتلتها لكل وحدة حجم. تبلغ كثافة نترات النحاس الصلبة عمومًا حوالي 2.32 جم/مل، بينما يمكن أن تختلف كثافة محاليلها المائية اعتمادًا على التركيز.
الوزن الجزيئي لنترات النحاس
الوزن الجزيئي لنترات النحاسيك هو مجموع الأوزان الذرية لجميع الذرات في صيغتها الكيميائية. بالنسبة لـ Cu(NO3)2، يبلغ الوزن الجزيئي حوالي 187.55 جم/مول.
هيكل نترات النحاس
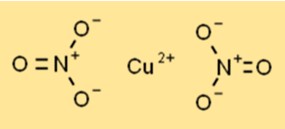
توجد نترات النحاسيك في صورة مادة صلبة بلورية زرقاء ذات بنية بلورية سداسية. كل أيون نحاس (Cu2+) محاط بست ذرات أكسجين من أيوني نترات، مما يخلق ترتيبًا متناسقًا. يساهم الهيكل في استقراره وتفاعله في العمليات الكيميائية المختلفة.
ذوبان نترات النحاس
نترات النحاسيك قابلة للذوبان بشكل معتدل في الماء. وهو يشكل محلول مائي عند إذابته في الماء، والذي يمكن استخدامه في تطبيقات مختلفة مثل الطلاء الكهربائي وككاشف في التفاعلات الكيميائية. ومع ذلك، فإن ذوبانه يتناقص مع انخفاض درجات الحرارة.
| مظهر | مادة صلبة بلورية زرقاء |
| جاذبية معينة | لا يوجد |
| لون | أزرق |
| يشم | عديم الرائحة |
| الكتلة المولية | 187.55 جرام/مول |
| كثافة | 2.32 جم/مل (صلب) |
| نقطة الانصهار | 256-260 درجة مئوية (493-500 درجة فهرنهايت) |
| نقطة الغليان | ينهار قبل الغليان |
| نقطة فلاش | لا يوجد |
| الذوبان في الماء | قابل للذوبان بشكل معتدل، ويشكل محلول مائي |
| الذوبان | يذوب في الماء |
| ضغط البخار | لا يوجد |
| كثافة بخار | لا يوجد |
| pKa | لا يوجد |
| الرقم الهيدروجيني | حامض |
السلامة ومخاطر نترات النحاس
تشكل نترات النحاسيك بعض المخاوف المتعلقة بالسلامة والمخاطر. ومن الضروري التعامل مع هذا المركب بحذر. الاتصال المباشر مع الجلد أو العينين قد يسبب تهيجًا أو حروقًا. استنشاق الغبار أو الأبخرة قد يسبب تهيج الجهاز التنفسي. عند تسخينه، يمكن أن يطلق أكاسيد النيتروجين السامة. تعتبر المادة أيضًا عاملًا مؤكسدًا وقد تشعل مواد قابلة للاشتعال عند ملامستها. يجب ارتداء معدات الحماية المناسبة، مثل القفازات والنظارات الواقية، عند العمل مع نترات النحاس. ويجب تخزينه بعيدًا عن المواد القابلة للاحتراق والمواد غير المتوافقة لتقليل المخاطر المحتملة. اتبع دائمًا تعليمات السلامة واستخدمه في منطقة جيدة التهوية.
| رموز الخطر | عامل مؤكسد، مسبب للتآكل، مهيج |
| وصف الأمان | التعامل مع الودائع. تجنب ملامسة الجلد والعينين. استخدام في منطقة جيدة التهوية. الابتعاد عن المواد القابلة للاحتراق. |
| أرقام تعريف الأمم المتحدة | UN3085 |
| رمز النظام المنسق | 28342910 |
| فئة الخطر | 5.1 (عامل مؤكسد) |
| مجموعة التعبئة | ثالثا |
| تسمم | ضارة إذا ابتلعت. قد يسبب تهيج الجلد والعين. استنشاق الغبار أو الأبخرة قد يسبب تهيج الجهاز التنفسي. |
طرق تصنيع نترات النحاس
هناك عدة طرق لتجميع نترات النحاسيك.
يتضمن النهج الشائع التفاعل بين أكسيد النحاس (CuO) أو هيدروكسيد النحاس (Cu(OH)2) مع حمض النيتريك (HNO3) . عند تحضير نترات النحاسيك، يمكن إضافة أكسيد النحاسيك أو هيدروكسيد النحاسيك ببطء إلى محلول حمض النيتريك، مما يؤدي إلى تكوين نترات النحاسيك والماء.
تتضمن الطريقة الأخرى التفاعل بين النحاس المعدني (Cu) وحمض النيتريك المركز. يتفاعل معدن النحاس مع حمض النيتريك لينتج نترات النحاس وثاني أكسيد النيتروجين (NO2) والماء. تتطلب هذه الطريقة معالجة دقيقة بسبب تكوين غاز ثاني أكسيد النيتروجين السام.
بدلًا من ذلك، يمكنك إذابة النحاس المعدني أو أكسيد النحاسيك في خليط من حمض النيتريك وبيروكسيد الهيدروجين (H2O2) لإنتاج نترات النحاسيك. تسمح هذه الطريقة بتفاعل أسرع وتنتج نترات النحاس النقي.
وأخيرًا، يمكن أن يؤدي تفاعل الإزاحة المزدوجة بين CuSO4 ونترات الصوديوم (NaNO3) أيضًا إلى إنتاج نترات النحاسيك. عن طريق خلط هذين الأملاح في الماء، تترسب نترات النحاسيك ويبقى المنتج الثانوي كبريتات الصوديوم مذابًا.
اتبع احتياطات السلامة أثناء التوليف حيث أن المواد الكيميائية المعنية تظهر تفاعلية. استخدم معدات الحماية المناسبة واستخدم الممارسات المخبرية المناسبة لضمان التوليف الناجح والآمن لنترات النحاس.
استخدامات نترات النحاس
تجد نترات النحاس تطبيقات مختلفة في صناعات مختلفة بسبب خصائصها الفريدة. بعض الاستخدامات البارزة تشمل:
- المحفز: يعمل كمحفز في عملية التخليق العضوي، حيث يسهل التفاعلات مثل تحويل الكحوليات إلى الألدهيدات أو الكيتونات.
- الألعاب النارية: تعتبر نترات النحاس مكونًا رئيسيًا في تركيبات الألعاب النارية، حيث تساهم في ظهور الألوان الزرقاء والخضراء للهب.
- الزراعة: في الزراعة، يعمل كمصدر للنحاس الموجود في الأسمدة لتوفير العناصر الغذائية الأساسية للنباتات.
- العامل المؤكسد: تعمل نترات النحاس على أكسدة المواد الأخرى بشكل فعال أثناء العمليات الكيميائية.
- طلاء المعادن: تقوم نترات النحاس بترسيب طبقة رقيقة من النحاس بشكل فعال على الأسطح المعدنية المختلفة أثناء عمليات الطلاء الكهربائي.
- الأصباغ والأصباغ: تساهم نترات النحاس بشكل فعال في تكوين أصباغ خضراء وزرقاء للسيراميك والزجاج والمنسوجات.
- عمليات التصوير الفوتوغرافي: تساهم نترات النحاس بشكل فعال في تطوير الصورة في بعض المحاليل الفوتوغرافية.
- الحفظ: يجد تطبيقه في حفظ الأخشاب من خلال المساعدة في تثبيت المواد الحافظة.
- تحضير مركبات النحاس الأخرى: وهو بمثابة مقدمة لتخليق مختلف المواد والمركبات القائمة على النحاس.
إن تعدد استخدامات نترات النحاس وتفاعليتها يجعلها مادة كيميائية ذات قيمة في مجموعة متنوعة من المجالات، من العمليات الصناعية إلى التطبيقات الفنية.
أسئلة:
س: ماذا يحدث عند تسخين نترات النحاس؟
ج: عند تسخينها، تتحلل نترات النحاسيك إلى أكسيد النحاسيك وغاز ثاني أكسيد النيتروجين والأكسجين.
س: هل نترات النحاس قابلة للذوبان في الماء؟
ج: نعم، نترات النحاسيك متوسطة الذوبان في الماء.
س: ما هي الصيغة الكيميائية لنترات النحاس؟
ج: الصيغة الكيميائية لنترات النحاسيك هي Cu(NO3)2.
س: هل نترات النحاس إلكتروليت قوي؟
ج: نعم، نترات النحاسيك عبارة عن إلكتروليت قوي، يتفكك إلى أيونات عندما يذوب في الماء.
س: ما هي شحنة نترات النحاس؟
ج: نترات النحاس لها شحنة صافية قدرها 0؛ إنه مركب محايد.
س: ما عدد ذرات النيتروجين الموجودة في 10.2 جم من نترات النحاس الثنائي؟
ج: يوجد ما يقرب من 0.161 مول من نترات النحاس الثنائي، وبالتالي ما يقرب من 0.322 مول من ذرات النيتروجين.
س: ما كمية الفضة التي يمكن إنتاجها من 3.00 مول من النحاس و 3.85 مول من نترات الفضة؟
ج: يمكن إنتاج 342.3 جم من الفضة باتباع المعادلة الكيميائية الموزونة.
س: هل نترات النحاس قابلة للذوبان؟
ج: نعم نترات النحاس تذوب في الماء.
س: ما هي صيغة نترات النحاس الثنائي؟
ج: صيغة نترات النحاس الثنائي (II) هي Cu(NO3)2.
س: ما الذي ينتج عن تفاعل استبدال Cu(NO3)2 وZn؟
ج: يتم إنتاج نترات الزنك (Zn(NO3)2) ومعدن النحاس (Cu) في تفاعل الاستبدال.
س: ما هو النحاس (NO3)2؟
ج: Cu(NO3)2 هي الصيغة الكيميائية لنترات النحاس، وهو مركب بلوري أزرق.
س: أي مما يلي اختزل في التفاعل التالي؟ النحاس (NO3)2 + الزنك -> الزنك (NO3)2 + النحاس
ج: يتم اختزال النحاس (Cu) أثناء التفاعل، ويكتسب إلكترونات لتكوين النحاس المعدني.
س: هل يتشكل Cu(OH)2 الصلب عند إذابة 0.075 جم من KOH في 1.0 لتر من Cu(NO3)2 1.0 × 10⁻³ M؟
ج: لا، لا يتشكل Cu(OH)2 الصلب نظرًا لأن Cu(NO3)2 يتأين تمامًا في المحلول ويوجد فائض من أيونات OH⁻ من KOH.
