نترات المغنيسيوم مركب بلوري أبيض له الصيغة الكيميائية Mg(NO3)2. يتم استخدامه في إنتاج الأسمدة والمتفجرات ومنتجات الألعاب النارية بسبب تفاعله العالي وخصائصه المؤكسدة.
| اسم الأيوباك | ثنائي نترات المغنيسيوم |
| الصيغة الجزيئية | ملغم(NO3)2 |
| CAS رقم | 10377-60-3 |
| المرادفات | حمض النيتريك، ملح المغنيسيوم. الأمم المتحدة 1474؛ نترات المغنيسيوم (II)؛ ملح المغنيسيوم لحمض النيتريك (2+) |
| إنتشي | إنتشي = 1S/Mg.2NO3/c;22-1(3)4/q+2;2-1 |
صيغة نترات المغنيسيوم
الصيغة الكيميائية لنترات المغنيسيوم هي Mg(NO3)2، مما يشير إلى أن المركب يحتوي على كاتيون مغنيسيوم واحد (Mg²⁺) واثنين من أنيونات النترات (NO₃⁻). تُستخدم هذه الصيغة لتمثيل قياس العناصر الكيميائية للمركب في المعادلات الكيميائية وتستخدم أيضًا لتحديد الوزن الجزيئي والخصائص الأخرى لنترات المغنيسيوم.
الكتلة المولية لنترات المغنيسيوم
تبلغ الكتلة المولية لنترات المغنيسيوم، والتي يتم تمثيلها بالصيغة الكيميائية Mg(NO3)2، حوالي 148.31 جم/مول. يمكن حساب هذه القيمة عن طريق إضافة الكتل الذرية للمغنيسيوم (24.31 جم / مول)، وذرتي نيتروجين (28.02 جم / مول لكل منهما) وست ذرات أكسجين (16.00 جم / مول لكل منهما) الموجودة في المركب. معرفة الكتلة المولية أمر بالغ الأهمية في تحديد كمية نترات المغنيسيوم اللازمة للتفاعلات الكيميائية أو تحضير المحاليل.
درجة غليان نترات المغنيسيوم
يحتوي Mg(NO3)2 على نقطة غليان عالية نسبيًا تبلغ حوالي 330 درجة مئوية (626 درجة فهرنهايت) عند الضغط الجوي. قد تختلف هذه القيمة قليلاً اعتمادًا على نقاء وتركيز المركب. تعتبر نقطة غليان Mg(NO3)2 مهمة في العمليات الصناعية التي تتضمن إنتاج الأسمدة والمتفجرات والألعاب النارية، وكذلك في التجارب المعملية.
نقطة انصهار نترات المغنيسيوم
تبلغ نقطة انصهار Mg(NO3)2، وهي درجة الحرارة التي يتحول عندها المركب الصلب إلى الحالة السائلة، حوالي 89 درجة مئوية (192 درجة فهرنهايت) للشكل اللامائي و95 درجة مئوية (203 درجة فهرنهايت) للشكل اللامائي. شكل لا مائي. شكل سداسي. يتم استخدام شكل سداسي هيدرات Mg(NO3)2 بشكل أكثر شيوعًا نظرًا لاستقراره وسهولة التعامل معه. نقطة الانصهار هي خاصية فيزيائية أساسية تستخدم لتحديد نقاء Mg(NO3)2 وكذلك في العمليات الصناعية المختلفة.
كثافة نترات المغنيسيوم جم/مل
تختلف كثافة Mg(NO3)2 حسب شكل المركب. تبلغ كثافة الشكل اللامائي حوالي 2.3 جم/سم مكعب، بينما تبلغ كثافة شكل سداسي الهيدرات حوالي 1.46 جم/سم3. تعتبر كثافة Mg(NO3)2 عاملاً حاسماً في تحديد حجم المركب المطلوب في التفاعلات الكيميائية، بالإضافة إلى تخزينه ونقله.
الوزن الجزيئي لنترات المغنيسيوم
يبلغ الوزن الجزيئي لـ Mg(NO3)2، وهو مجموع الأوزان الذرية لجميع العناصر الموجودة في المركب، حوالي 148.31 جم/مول. هذه القيمة مهمة في الحسابات الكيميائية المختلفة، لا سيما لتحديد كمية Mg(NO3)2 المطلوبة في التفاعلات أو في تحضير المحاليل.
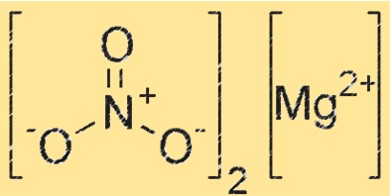
هيكل نترات المغنيسيوم
يحتوي Mg(NO3)2 على بنية بلورية تنتمي إلى النظام البلوري المعيني العظمي. يتكون المركب من كاتيونات المغنيسيوم (Mg²⁺) وأنيونات النترات (NO₃⁻)، مع كل كاتيون مغنيسيوم محاط بستة أنيونات نترات في ترتيب ثماني السطوح. يلعب التركيب البلوري لـ Mg(NO3)2 دورًا حاسمًا في تفاعله وخصائصه.
| مظهر | مادة صلبة بلورية بيضاء |
| جاذبية معينة | 2.3 (لا مائي)، 1.46 (سداسي هيدرات) |
| لون | أبيض |
| يشم | عديم الرائحة |
| الكتلة المولية | 148.31 جرام/مول |
| كثافة | 2.3 جم/سم3 (لا مائي)، 1.46 جم/سم3 (سداسي هيدرات) |
| نقطة الانصهار | 89 درجة مئوية (لا مائي)، 95 درجة مئوية (سداسي هيدرات) |
| نقطة الغليان | 330 درجة مئوية |
| نقطة فلاش | غير قابل للتطبيق |
| الذوبان في الماء | 234 جم/لتر (لا مائي)، 156 جم/لتر (سداسي هيدرات) عند 20 درجة مئوية |
| الذوبان | قابل للذوبان في الماء والإيثانول والميثانول |
| ضغط البخار | 0.000009 ملم زئبق عند 20 درجة مئوية |
| كثافة بخار | غير قابل للتطبيق |
| pKa | 1.8 |
| الرقم الهيدروجيني | 4.5-6.0 (محلول 5%) |
سلامة ومخاطر نترات المغنيسيوم
يمكن أن يشكل Mg(NO3)2 مخاطر مختلفة على السلامة إذا لم يتم التعامل معه بشكل صحيح. قد يسبب تهيجًا وحروقًا في الجلد والعينين والجهاز التنفسي عند ملامسته أو استنشاقه. يعد المركب أيضًا عامل مؤكسد قوي ويمكن أن يتفاعل بعنف مع المواد العضوية، بما في ذلك المواد القابلة للاشتعال والقابلة للاشتعال. استنشاق غبار المغنيسيوم (NO3)2 يمكن أن يسبب تهيج الجهاز التنفسي وحتى تلف الرئة. قم بتخزين ومعالجة Mg(NO3)2 في منطقة باردة وجافة وجيدة التهوية، بعيدًا عن مصادر الاشتعال. عند التعامل مع هذا المركب، استخدم معدات الحماية الشخصية المناسبة مثل القفازات ونظارات السلامة.
| رموز الخطر | عامل مؤكسد |
| وصف الأمان | تجنب ملامسة المواد القابلة للاشتعال. ارتداء معدات الحماية الشخصية. الابتعاد عن مصادر الاشتعال. |
| معرفات | الأمم المتحدة 1474 |
| رمز النظام المنسق | 283429 |
| فئة الخطر | 5.1 (العوامل المؤكسدة) |
| مجموعة التعبئة | ثانيا |
| تسمم | الجرعة المميتة 50 (عن طريق الفم، للفئران): 3500 ملغم/كغم؛ الجرعة المميتة 50 (الجلدية، في الأرانب): أكبر من 2000 ملغم/كغم. لا تعتبر نترات المغنيسيوم مادة مسرطنة أو مطفرة أو ماسخة. |
طرق تصنيع نترات المغنيسيوم
يمكن تصنيع نترات المغنيسيوم (Mg(NO3)2) بعدة طرق، بما في ذلك تفاعل أكسيد المغنيسيوم أو هيدروكسيد المغنيسيوم مع حمض النيتريك.
تتضمن إحدى الطرق إضافة أكسيد المغنيسيوم إلى محلول حمض النيتريك في دورق، ثم تسخين الخليط بلطف حتى يذوب. للحصول على بلورات Mg(NO3)2، قم بتصفية المحلول لإزالة الشوائب وتبخر المذيب.
تتضمن طريقة التخليق الأخرى تفاعل معدن المغنيسيوم مع حمض النيتريك . أضف شرائح المغنيسيوم إلى الحمض واترك التفاعل يستمر حتى يذوب المعدن بالكامل. ثم قم بتبخر المحلول الذي تم الحصول عليه للحصول على بلورات Mg(NO3)2.
تذوب كربونات المغنيسيوم في حمض النيتريك لتكوين Mg(NO3)2 وثاني أكسيد الكربون. قم بتصفية المحلول الناتج وقم بتبخيره للحصول على بلورات Mg(NO3)2.
هناك طريقة أخرى وهي تفاعل هيدروكسيد المغنيسيوم مع حمض النيتريك لإنتاج Mg(NO3)2 والماء. تتم بعد ذلك تنقية المحلول الناتج عن طريق الترشيح والتبخر للحصول على بلورات Mg(NO3)2.
استخدامات نترات المغنيسيوم
لنترات المغنيسيوم العديد من الاستخدامات في مختلف الصناعات والتطبيقات. بعض الاستخدامات الرئيسية لـ Mg(NO3)2 هي:
- الزراعة: يستخدم كسماد، وخاصة للمحاصيل التي تحتاج إلى مستويات عالية من المغنيسيوم، مثل الطماطم والفلفل والحمضيات. يساعد على تحسين نمو النبات وتحسين جودة المحاصيل وإنتاجيتها.
- منتجات الألعاب النارية: تستخدم كمؤكسد في الألعاب النارية وغيرها من تطبيقات الألعاب النارية لأنها يمكن أن تنتج لهبًا ساطعًا ومكثفًا وتساعد في التحكم في معدل الاحتراق.
- إنتاج الزجاج: يستخدم كتدفق في إنتاج الزجاج لخفض درجة انصهار الزجاج وتحسين خصائصه الانسيابية.
- التخليق الكيميائي: يستخدم ككاشف في تفاعلات التخليق الكيميائي المختلفة، مثل إنتاج مركبات المغنيسيوم الأخرى، والمحفزات، والمستحضرات الصيدلانية.
- الحفظ: يستخدم كمادة حافظة للأغذية لمنع نمو البكتيريا والكائنات الحية الدقيقة الأخرى.
- التطبيقات الصناعية: يستخدم في إنتاج أكسيد المغنيسيوم وهيدروكسيد المغنيسيوم، اللذين يستخدمان كمثبطات للهب، وفي معالجة مياه الصرف الصحي وكعامل معادل في التربة الحمضية.
- الأبحاث المخبرية: تستخدم في التجارب والأبحاث المخبرية المختلفة، مثل إعداد المحاليل القياسية واختبار الإجراءات التحليلية.
أسئلة:
س: هل المغنيسيوم (NO3)2 قابل للذوبان؟
ج: نعم، نترات المغنيسيوم شديدة الذوبان في الماء.
س: ما هي صيغة نترات المغنيسيوم؟
ج: صيغة نترات المغنيسيوم هي Mg(NO3)2.
س: ما هي الكتلة المولية لـ Mg(NO3)2؟
ج: الكتلة المولية لـ Mg(NO3)2 هي 148.31 جم/مول.
س: ما هو الوزن الصيغةي لـ Mg(NO3)2؟
ج: الوزن الصيغةي لـ Mg(NO3)2 هو 148.31 جم/مول.
س: ما هو الاسم المنهجي لـ Mg(NO3)2؟
ج: الاسم المنهجي لـ Mg(NO3)2 هو ثنائي نترات المغنيسيوم.
س: ما هو تركيز أيونات النترات في محلول 0.125 Mg(NO3)2؟
ج: تركيز أيونات النترات في محلول 0.125 Mg(NO3)2 هو 0.25 M، لأن هناك أيونين نترات لكل أيون مغنيسيوم.
س: ما هي صيغة كتلة Mg(NO3)2؟
ج: الصيغة الكتلية لـ Mg(NO3)2 هي 148.31 جم/مول.
