نترات الفضة (AgNO3) هو مركب كيميائي يتكون من الفضة والنيتروجين والأكسجين. يستخدم عادة في التصوير الفوتوغرافي والطب وككاشف مختبري للتفاعلات المختلفة.
| اسم الأيوباك | نترات الفضة |
| الصيغة الجزيئية | AgNO3 |
| CAS رقم | 7761-88-8 |
| المرادفات | أحادي نترات الفضة، ملح الفضة (1+) من حمض النيتريك، نترات الفضة (I). |
| إنتشي | إنتشي=1S/Ag.NO3/c;2-1(3)4/q+1;-1 |
خصائص نترات الفضة
صيغة نترات الفضة
صيغة أحادي نترات الفضة هي AgNO3. وتتكون من ذرة فضة واحدة (Ag) وذرة نيتروجين واحدة (N) وثلاث ذرات أكسجين (O). تمثل الصيغة نسبة الذرات في جزيء أحادي نترات الفضة.
نترات الفضة الكتلة المولية
يتم حساب الكتلة المولية لأحادي نترات الفضة عن طريق إضافة الكتل الذرية للعناصر المكونة لها. تبلغ الكتلة الذرية للفضة 107.87 جم/مول، وكتلة النيتروجين 14.01 جم/مول، وكتلة كل ذرة أكسجين 16.00 جم/مول. إضافتها تعطي كتلة مولية تبلغ حوالي 169.87 جم/مول لأحادي نترات الفضة.
درجة غليان نترات الفضة
تبلغ درجة غليان أحادي نترات الفضة حوالي 440 درجة مئوية (824 درجة فهرنهايت). عند درجة الحرارة هذه، يمر المركب بمرحلة انتقالية من الحالة السائلة إلى الحالة الغازية. تشير نقطة الغليان إلى درجة الحرارة التي يساوي فيها ضغط بخار المادة الضغط الجوي.
نقطة انصهار نترات الفضة
تبلغ درجة انصهار أحادي نترات الفضة حوالي 209 درجة مئوية (408 درجة فهرنهايت). هذه هي درجة الحرارة التي يتحول عندها الشكل الصلب لأحادي نترات الفضة إلى سائل. نقطة الانصهار هي خاصية مميزة للمادة وتساعد في تحديد سلوكها الجسدي في ظل ظروف مختلفة.
كثافة نترات الفضة جم/مل
تبلغ كثافة أحادي نترات الفضة حوالي 4.35 جم / مل. الكثافة هي مقياس لكمية الكتلة الموجودة في حجم معين. ويتم حسابه عن طريق قسمة كتلة المادة على حجمها. تشير كثافة أحادي نترات الفضة إلى مدى ضغطها أو مدى تركيزها في مساحة معينة.
الوزن الجزيئي لنترات الفضة
يبلغ الوزن الجزيئي لأحادي نترات الفضة، والذي يُسمى أيضًا الكتلة المولية، حوالي 169.87 جم/مول. وهو يمثل مجموع الكتل الذرية لجميع الذرات الموجودة في جزيء أحادي نترات الفضة. يتم استخدام الوزن الجزيئي في الحسابات والتحويلات المختلفة التي تتضمن كميات المركب.
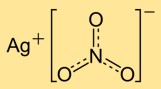
هيكل نترات الفضة
تحتوي أحادي نترات الفضة على بنية بلورية تتكون من كاتيونات الفضة (Ag+) وأنيونات النترات (NO3-). وتحاط أيونات الفضة بأيونات النترات لتشكل شبكة منتظمة. يساهم هذا التركيب الأيوني في استقرار وخصائص المركب.
ذوبان نترات الفضة
أحادي نترات الفضة قابل للذوبان بشدة في الماء. يذوب بسهولة في الماء ليشكل محلول شفاف عديم اللون. تعد قابلية ذوبان أحادي نترات الفضة في الماء خاصية أساسية وتلعب دورًا حاسمًا في العديد من التطبيقات، مثل الطب والتصوير الفوتوغرافي والتفاعلات الكيميائية.
| مظهر | مادة صلبة بلورية بيضاء |
| جاذبية معينة | 4.35 جم/مل |
| لون | عديم اللون |
| يشم | عديم الرائحة |
| الكتلة المولية | 169.87 جرام/مول |
| كثافة | 4.35 جم/مل |
| نقطة الانصهار | 209 درجة مئوية (408 درجة فهرنهايت) |
| نقطة الغليان | 440 درجة مئوية (824 درجة فهرنهايت) |
| نقطة فلاش | غير قابل للتطبيق |
| الذوبان في الماء | قابل للذوبان |
| الذوبان | قابل للذوبان في الماء والمذيبات العضوية مثل الإيثانول |
| ضغط البخار | 0.26 ملم زئبق عند 25 درجة مئوية (77 درجة فهرنهايت) |
| كثافة بخار | غير قابل للتطبيق |
| pKa | – |
| الرقم الهيدروجيني | حمضية (حوالي 5-6 درجة حموضة في محلول مائي) |
السلامة ومخاطر نترات الفضة
تشكل أحادي نترات الفضة بعض مخاطر السلامة ويجب توخي الحذر عند التعامل مع المركب. ويعتبر ضارًا إذا تم تناوله أو استنشاقه أو ملامسته للجلد أو العينين. وينبغي استخدام تدابير الحماية مثل القفازات ونظارات السلامة ومعاطف المختبر. يمكن أن يسبب ذلك تهيجًا وحروقًا وبقعًا على الجلد والأسطح الأخرى. عند تسخينه، يمكن أن يطلق أكاسيد النيتروجين السامة. يجب أن يتم تخزينه في مكان بارد وجاف بعيدا عن المواد غير المتوافقة. يجب تنظيف الانسكابات على الفور ويجب أن يتبع التخلص من النفايات الإرشادات المناسبة لتجنب تلوث البيئة.
| رموز الخطر | تآكل، مؤكسد |
| وصف الأمان | يسبب حروقا جلدية شديدة وتلفا للعين. |
| معرفات الأمم المتحدة | UN 1493 (أحادي نترات الفضة الصلبة) |
| رمز النظام المنسق | 2843.10.00 |
| فئة الخطر | فئة 5.1 (المواد المؤكسدة) |
| مجموعة التعبئة | جنرال إلكتريك الثاني (متوسط) |
| تسمم | سامة للحياة المائية ولها آثار طويلة المدى. |
طرق تصنيع نترات الفضة
هناك طرق مختلفة لتجميع أحادي نترات الفضة.
تتضمن الطريقة الشائعة التفاعل بين الفضة المعدنية وحمض النيتريك . في هذه العملية، يقوم حمض النيتريك المخفف بإذابة الفضة لإنتاج أحادي نترات الفضة. تتضمن الطريقة الأخرى تفاعل أكسيد الفضة أو كربونات الفضة مع حمض النيتريك، مما يؤدي إلى تكوين أحادي نترات الفضة.
بالإضافة إلى ذلك، فإن التفاعل بين كلوريد الفضة وحمض النيتريك يمكن أن ينتج أيضًا أحادي نترات الفضة. يذيب حمض النيتريك كلوريد الفضة، ويزيح أيونات الكلوريد ويشكل أحادي نترات الفضة.
بالإضافة إلى ذلك، فإن تفاعل كبريتات الفضة مع ملح النترات القابل للذوبان، مثل نترات الصوديوم، يسمح بالحصول على أحادي نترات الفضة. تتفاعل كبريتات الفضة مع ملح النترات في محلول مائي، مما يؤدي إلى تكوين أحادي نترات الفضة وملح كبريتات قابل للذوبان.
عند تنفيذ هذه الأساليب الاصطناعية، من المهم اتخاذ احتياطات السلامة المناسبة واستخدام الأحماض المسببة للتآكل والمركبات السامة المحتملة. وينبغي أيضًا اتباع البروتوكولات والمبادئ التوجيهية المخبرية لضمان الإعداد الدقيق والتعامل مع أحادي نترات الفضة.
استخدامات نترات الفضة
أحادي نترات الفضة له استخدامات عديدة في مجالات مختلفة. فيما يلي بعض التطبيقات الشائعة:
- التصوير الفوتوغرافي: يستخدم التصوير الفوتوغرافي التقليدي بالأبيض والأسود أحادي نترات الفضة كمركب حساس للضوء يتفاعل مع الضوء، ويشكل جزيئات الفضة ويطور الصور الفوتوغرافية.
- الطب: تستخدم التطبيقات الطبية أحادي نترات الفضة لخصائصه المطهرة في العناية بالجروح. تطبيقه الموضعي يمنع الالتهابات ويحفز الشفاء ويعالج الحروق والقروح وجروح الجلد الأخرى.
- كاشف المختبر: تعمل أحادي نترات الفضة ككاشف مختبري متعدد الاستخدامات، مما يتيح التفاعلات الكيميائية المختلفة ويستخدم في الكيمياء التحليلية للكشف عن وجود الهاليدات والمركبات الأخرى.
- طلاء الفضة: تستخدم عمليات الطلاء الكهربائي أحادي نترات الفضة لترسيب طبقة رقيقة من الفضة على الأسطح المختلفة. هذا الاستخدام شائع لأغراض الديكور ولتوفير مقاومة للتآكل.
- تلطيخ وتلطيخ: يستخدم علم الأنسجة والفحص المجهري أحادي نترات الفضة كصبغة لتحسين رؤية هياكل محددة في العينات البيولوجية. وتستخدمه صناعة النسيج لصبغ الأقمشة.
- النقش: الطبيعة المسببة للتآكل لأحادي نترات الفضة تسمح باستخدامها النشط في أنماط النقش على الزجاج والمرايا. فهو يزيل الطبقات السطحية بشكل انتقائي، مما يخلق أنماطًا معقدة.
- تعليم الكيمياء: تستخدم المؤسسات التعليمية بشكل فعال أحادي نترات الفضة لإجراء التجارب والعروض الكيميائية، وذلك بسبب تفاعلاتها المميزة وتأثيراتها البصرية.
- محفز الفضة: في بعض التفاعلات الكيميائية، تعمل أحادي نترات الفضة بشكل فعال كمحفز، مما يسهل تحويل المواد المتفاعلة إلى المنتجات المطلوبة.
أسئلة:
س: هل AgNO3 قابل للذوبان في الماء؟
ج: نعم، AgNO3 قابل للذوبان في الماء.
س: ما هو AgNO3؟
ج: AgNO3 هو أحادي نترات الفضة، وهو مركب كيميائي يتكون من الفضة والنيتروجين والأكسجين.
س: ما هي الأيونات المتفرجة في التفاعل بين KCl(aq) وAgNO3(aq)؟
ج: في التفاعل بين KCl(aq) وAgNO3(aq)، تكون الأيونات المتفرجة K+ وNO3-.
س: ما الأيونات، إن وجدت، التي تعتبر أيونات متفرجة في التفاعل AgNO3(aq) + NaCl(aq) → AgCl(s) + NaNO3(aq)؟
ج: في التفاعل AgNO3(aq) + NaCl(aq) → AgCl(s) + NaNO3(aq)، تكون الأيونات المتفرجة Na+ وNO3-.
س: ما عدد مولات النحاس اللازمة للتفاعل مع 5.8 مول من AgNO3؟
ج: المعادلة المتوازنة ضرورية لتحديد عدد مولات النحاس اللازمة للتفاعل مع 5.8 مول من AgNO3.
س: أي المركبات التالية تنتج راسبًا مع AgNO3؟
ج: المركبات التي تحتوي على أيونات Cl- أو Br- أو I- سوف تنتج راسبًا يحتوي على AgNO3.
س: هل AgNO3 مركب أيوني؟
ج: نعم، AgNO3 مركب أيوني.
س: هل AgNO3 إلكتروليت قوي؟
ج: نعم، AgNO3 هو إلكتروليت قوي.
س: هل AgNO3 موصل للكهرباء؟
ج: نعم، يقوم AgNO3 بتوصيل الكهرباء عند إذابته في الماء.
س: هل نترات الفضة ملح؟
ج: نعم، أحادي نترات الفضة ملح.
س: هل يمكنني شراء نترات الفضة؟
ج: نعم، أحادي نترات الفضة متاح تجاريًا للشراء.
س: هل نترات الفضة هي الحل؟
ج: يمكن أن توجد أحادي نترات الفضة في الحالة الصلبة أو في الحالة المحلولية، حسب حالتها.
س: كيفية إزالة وصمة عار نترات الفضة؟
ج: يمكن إزالة بقع أحادي نترات الفضة عن طريق معالجة المنطقة المصابة بعامل اختزال خفيف، مثل بيروكسيد الهيدروجين أو ثيوكبريتات الصوديوم.
س: هل نترات الفضة تذوب في الماء؟
ج: نعم، أحادي نترات الفضة قابل للذوبان في الماء.
س: ما هو الراسب الذي يتشكل عند خلط محاليل نترات الفضة وكرومات البوتاسيوم؟
ج: عند خلط محاليل أحادي نترات الفضة وكرومات البوتاسيوم يتكون راسب أصفر من كرومات الفضة (Ag2CrO4).
س: ما هي الكتلة المولية لنترات الفضة؟
ج: تبلغ الكتلة المولية لأحادي نترات الفضة (AgNO3) حوالي 169.87 جم/مول.
س: تضاف الفضة المعدنية إلى محلول نترات الرصاص الثنائي. ما هو التفاعل الكيميائي المتوازن؟
ج: التفاعل الكيميائي المتوازن هو 2Ag + Pb(NO3)2 → 2AgNO3 + Pb.
