نترات الزنك (Zn(NO3)2) مركب يحتوي على أيونات الزنك والنترات. وهو قابل للذوبان في الماء ويستخدم عادة في الصناعات لمختلف التطبيقات، بما في ذلك كمحفز وفي إنتاج الأصباغ والأصباغ.
| اسم الأيوباك | نترات الزنك |
| الصيغة الجزيئية | الزنك (NO3)2 |
| CAS رقم | 7779-88-6 |
| المرادفات | ثنائي نترات الزنك، ملح الزنك لحمض النيتريك، السيلوكسان، نترات الزنك |
| إنتشي | إنتشي=1S/2NO3.Zn/c2 2-1(3)4;/q2 -1;+2 |
خصائص نترات الزنك
صيغة نترات الزنك
صيغة ثنائي نترات الزنك هي Zn(NO3)2. وهو يتكون من أيون زنك واحد (Zn2+) وأيونين NO3- مرتبطين معًا بروابط أيونية. تمثل الصيغة نسبة العناصر الموجودة في المركب.
نترات الزنك الكتلة المولية
يمكن حساب الكتلة المولية لثنائي نترات الزنك عن طريق إضافة الكتل الذرية للعناصر المكونة له. تبلغ الكتلة الذرية للزنك (Zn) حوالي 65.38 جرامًا لكل مول، والكتلة الذرية للنيتروجين (N) والأكسجين (O) في أيونات NO3- تقريبًا 14.01 و16.00 جرامًا لكل مول على التوالي. ولذلك، فإن الكتلة المولية لثنائي نترات الزنك تبلغ حوالي 189.38 جرامًا لكل مول.
درجة غليان نترات الزنك
ليس لثنائي نترات الزنك نقطة غليان محددة لأنه يتحلل قبل أن يصل إلى نقطة الغليان. ومع ذلك، عند تسخينه، فإنه يتحلل إلى أكسيد الزنك وثاني أكسيد النيتروجين والأكسجين. يحدث تفاعل التحلل هذا عند درجة حرارة 140 درجة مئوية (284 درجة فهرنهايت)، مما يؤدي إلى إطلاق أبخرة ثاني أكسيد النيتروجين البني.
نقطة انصهار نترات الزنك
تعتمد نقطة انصهار ثنائي نترات الزنك على حالة الماء فيه. يذوب الشكل اللامائي لثنائي نترات الزنك (Zn(NO3)2) عند حوالي 238 درجة مئوية (460 درجة فهرنهايت). ومع ذلك، فإن شكل سداسي الهيدرات (Zn(NO3)2·6H2O) له نقطة انصهار أقل تبلغ حوالي 36 درجة مئوية (97 درجة فهرنهايت) لأنه يحتوي على جزيئات الماء في بنيته البلورية.
كثافة نترات الزنك جم / مل
تختلف كثافة ثنائي نترات الزنك حسب تركيزه ودرجة حرارته. ومع ذلك، في ظل الظروف القياسية، تبلغ كثافة الشكل اللامائي حوالي 2.065 جرام لكل ملليلتر (جم / مل). كثافة شكل سداسي الهيدرات أعلى قليلاً بسبب وجود جزيئات الماء.
الوزن الجزيئي لنترات الزنك
يتم حساب الوزن الجزيئي لثنائي نترات الزنك عن طريق إضافة الكتل الذرية للعناصر المكونة له. يبلغ الوزن الجزيئي لثنائي نترات الزنك حوالي 189.38 جرامًا لكل مول كما ذكرنا سابقًا.
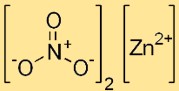
هيكل نترات الزنك
ثنائي نترات الزنك له بنية أيونية، مع كاتيون الزنك (Zn2+) محاط بستة جزيئات ماء في شكل سداسي هيدرات. توجد أيونات النترات (NO3-) ككيانات منفصلة في الشبكة البلورية.
ذوبان نترات الزنك
ثنائي نترات الزنك قابل للذوبان بشدة في الماء. تزداد الذوبان مع درجة الحرارة. في درجة حرارة الغرفة، يمكن أن يذوب حوالي 118 جرامًا من ثنائي نترات الزنك في 100 جرام من الماء، مما ينتج عنه محلول مشبع.
| مظهر | بلورات عديمة اللون |
| جاذبية معينة | 2,065 جم/مل |
| لون | عديم اللون |
| يشم | عديم الرائحة |
| الكتلة المولية | 189.38 جرام/مول |
| كثافة | 2,065 جم/مل |
| نقطة الانصهار | 238 درجة مئوية (460 درجة فهرنهايت) (لا مائي) |
| نقطة الغليان | يتحلل (~140 درجة مئوية/284 درجة فهرنهايت) |
| نقطة فلاش | غير قابل للتطبيق |
| الذوبان في الماء | قابل للذوبان جدا في الماء |
| الذوبان | يذوب في الماء |
| ضغط البخار | غير متاح |
| كثافة بخار | غير متاح |
| pKa | غير قابل للتطبيق |
| الرقم الهيدروجيني | ~4 (محلول مائي) |
سلامة ومخاطر نترات الزنك
يشكل ثنائي نترات الزنك بعض مخاطر السلامة التي يجب أخذها في الاعتبار. ومن المهم التعامل معها بعناية لمنع المخاطر المحتملة. الاتصال مع المركب قد يسبب تهيج الجلد والعين. قد يسبب تناول أو استنشاق ثنائي نترات الزنك اضطرابًا في الجهاز الهضمي وضيقًا في التنفس. ومن المستحسن استخدام تدابير الحماية المناسبة، مثل القفازات والنظارات الواقية، عند العمل مع ثنائي نترات الزنك. بالإضافة إلى ذلك، يجب تخزينه في منطقة جيدة التهوية، بعيدًا عن المواد غير المتوافقة. في حالة التعرض العرضي أو الابتلاع، يوصى باستشارة الطبيب. إن اتباع بروتوكولات السلامة المناسبة يضمن التعامل الآمن مع ثنائي نترات الزنك واستخدامه.
| رموز الخطر | عامل مؤكسد |
| وصف الأمان | يسبب تهيج الجلد والعين. تجنب الابتلاع والاستنشاق. التعامل مع التدابير الوقائية المناسبة. |
| أرقام تعريف الأمم المتحدة | رقم الأمم المتحدة 1514 (لا مائي)، رقم الأمم المتحدة 1515 (سداسي هيدرات) |
| رمز النظام المنسق | 28342990 |
| فئة الخطر | 5.1 (المواد المؤكسدة) |
| مجموعة التعبئة | الثاني (اللامائي)، الثالث (سداسي هيدرات) |
| تسمم | سامة إلى حد ما |
طرق تصنيع نترات الزنك
هناك طرق مختلفة لتوليف ثنائي نترات الزنك. النهج الشائع هو التفاعل بين الزنك المعدني وحمض النيتريك . في هذه الطريقة، يتفاعل الزنك مع حمض النيتريك لإنتاج ثنائي نترات الزنك وإطلاق غاز الهيدروجين. يتحكم المشغلون بعناية في التفاعل للحفاظ على السلامة.
تتضمن الطريقة الأخرى التفاعل بين أكسيد الزنك وحمض النيتريك . يذوب أكسيد الزنك في حمض النيتريك، مما يؤدي إلى تكوين ثنائي نترات الزنك والماء. هذه الطريقة مفيدة عندما يكون أكسيد الزنك متاحًا بسهولة.
بالإضافة إلى ذلك، يمكن أن تتفاعل كربونات الزنك مع حمض النيتريك لإنتاج ثنائي نترات الزنك. تتفاعل الكربونات مع حمض النيتريك مكونًا ثاني أكسيد الكربون والماء وثنائي نترات الزنك.
ومن المهم ملاحظة أن هذه التفاعلات يجب أن تتم في ظل ظروف معملية مناسبة مع اتخاذ احتياطات السلامة اللازمة. وينبغي ارتداء معدات الحماية المناسبة، مثل القفازات والنظارات الواقية، ويجب إجراء التفاعلات في منطقة جيدة التهوية.
بشكل عام، توفر هذه الطرق طرقًا فعالة لتصنيع ثنائي نترات الزنك، مما يتيح استخدامه في التطبيقات الصناعية المختلفة.
استخدامات نترات الزنك
يجد ثنائي نترات الزنك تطبيقات في مختلف الصناعات بسبب خصائصه المتنوعة. فيما يلي بعض الاستخدامات الرئيسية لثنائي نترات الزنك:
- المحفز: يحفز ثنائي نترات الزنك التفاعلات الكيميائية المختلفة، مما يسهل إنتاج الأصباغ والمواد الصيدلانية والبوليمرات.
- الطلاء الكهربائي: في عمليات الطلاء الكهربائي، يقوم ثنائي نترات الزنك بترسيب طبقة من الزنك على الأسطح المعدنية، مما يمنح مقاومة للتآكل ويحسن المظهر.
- الأصباغ والأصباغ: يعمل ثنائي نترات الزنك كمقدمة في إنتاج الأصباغ والأصباغ التي تحتوي على الزنك، وهي ضرورية للدهانات والطلاءات والمنسوجات.
- الأسمدة: يعمل ثنائي نترات الزنك كمصدر للزنك في الأسمدة، مما يضمن حصول النباتات على العناصر الغذائية الكافية للنمو والتطور.
- صناعة الزجاج: يلعب ثنائي نترات الزنك دورًا فعالًا في صناعة الزجاج، حيث يعمل على تحسين الخصائص البصرية مثل الشفافية ومعامل الانكسار.
- معالجة المياه: يلعب ثنائي نترات الزنك دوراً أساسياً في أنظمة معالجة المياه، والتحكم في نمو الطحالب والبكتيريا والحفاظ على جودة المياه.
- الكاشف المعملي: في العديد من التجارب المعملية، يعمل ثنائي نترات الزنك بشكل فعال ككاشف، خاصة في الكيمياء التحليلية والأبحاث.
- الطب والمستحضرات الصيدلانية: يساهم ثنائي نترات الزنك بشكل فعال في بعض التركيبات الصيدلانية والأدوية الموضعية بسبب خصائصه المضادة للميكروبات.
- مثبطات اللهب: يعتبر ثنائي نترات الزنك مكونًا رئيسيًا في تركيبات مثبطات اللهب، مما يقلل بشكل فعال من قابلية المواد للاشتعال.
- صناعة النسيج: في عمليات صباغة وطباعة المنسوجات، يعمل ثنائي نترات الزنك بشكل فعال على تحسين ثبات اللون وتحسين امتصاص الصبغة.
تسلط هذه التطبيقات المتنوعة الضوء على أهمية ثاني نترات الزنك في العديد من الصناعات، مما يساهم في مجموعة من المنتجات والعمليات.
أسئلة:
س: هل نترات الزنك قابلة للذوبان؟
ج: نعم، ثنائي نترات الزنك قابل للذوبان في الماء.
س: كيفية ترسيب كربونات الزنك من نترات الزنك؟
ج: لترسيب كربونات الزنك من Zn(NO3)2، أضف محلول كربونات الصوديوم أو بيكربونات الصوديوم إلى محلول ثنائي نترات الزنك، مما يؤدي إلى تكوين كربونات الزنك على شكل راسب.
س: هل يتفاعل الزنك مع نترات الفضة؟
ج: نعم، يتفاعل الزنك مع نترات الفضة، فيزيح معدن الفضة ويشكل ثنائي نترات الزنك.
س: هل نترات الزنك ملح؟
ج: نعم، نترات الزنك عبارة عن ملح يتكون من كاتيونات الزنك (Zn2+) وأيونات NO3-.
س: ما الذي يتكون عند تفاعل نترات الزنك مع هيدروكسيد البوتاسيوم؟
ج: عندما يتفاعل Zn(NO3)2 مع هيدروكسيد البوتاسيوم، يترسب Zn(OH)2 وتتكون نترات البوتاسيوم.
س: ما هي صيغة نترات الزنك الليثيوم؟
ج: صيغة ثنائي نترات الليثيوم والزنك هي LiZn(NO3)3.
س: كيفية توحيد محلول نترات المغنيسيوم ونترات الزنك؟
ج: لتوحيد محاليل نترات المغنيسيوم وثنائي نترات الزنك، يمكن استخدام طرق المعايرة مع كاشف قياسي مناسب.
س: ما هو الحمض وأكسيد المعدن المستخدم لإنتاج نترات الزنك؟
ج: يستخدم حمض النيتريك (HNO3) وأكسيد الزنك (ZnO) لإنتاج ثنائي نترات الزنك.
س: ما هي المنتجات التي تنتج عند إضافة الزنك إلى محلول نترات الرصاص؟
ج: عند إضافة الزنك إلى محلول نترات الرصاص يتكون ثنائي نترات الزنك والرصاص المعدني.
س: ما هي نترات الزنك؟
ج: ثنائي نترات الزنك هو مركب كيميائي يتكون من كاتيونات الزنك (Zn2+) وأنيونات NO3، والتي توجد غالبًا في صورة مادة صلبة بلورية.
س: ما عدد ذرات الأكسجين الموجودة في 1.50 مول من Zn(NO3)2؟
ج: في 1.50 مول من Zn(NO3)2 يوجد 9.00 مول أو 27.00 ذرة أكسجين.
س: ما كتلة Zn(NO3)2 التي يجب تخفيفها إلى كتلة 1.00 كجم باستخدام H2O لتحضير 97 جزء في المليون Zn2+(aq)؟
ج: لتحضير محلول يحتوي على 97 جزء في المليون من Zn2+(aq)، يجب تخفيف حوالي 97 مجم من Zn(NO3)2 بالماء إلى كتلة قدرها 1.00 كجم.
