نتريت الصوديوم (NaNO2) هو مركب كيميائي يستخدم عادة كمادة حافظة للأغذية لمنع نمو البكتيريا وتحسين لون ونكهة اللحوم المعالجة مثل لحم الخنزير المقدد والنقانق.
| اسم الأيوباك | نترات الصوديوم |
| الصيغة الجزيئية | نانو2 |
| CAS رقم | 7632-00-0 |
| المرادفات | حمض النيتروز، ملح الصوديوم؛ E250؛ نتريوم نيتريت. نترات الصوديوم؛ نتريتو الصوديوم. الأمم المتحدة 1500 |
| إنتشي | InChI=1S/NO2.Na/c2-1-3;/q-1;+1 |
خصائص نتريت الصوديوم
صيغة نتريت الصوديوم
الصيغة الكيميائية لنتريت الصوديوم هي NaNO2. يشير هذا إلى أن مولًا واحدًا من نتريت الصوديوم يحتوي على كاتيون صوديوم واحد، وذرة نيتروجين واحدة، وذرتين أكسجين. تُستخدم الصيغة لتمثيل تركيبة المادة ويمكن استخدامها للتنبؤ بالتفاعلات التي قد تخضع لها المادة.
نتريت الصوديوم الكتلة المولية
NaNo2 له كتلة مولية تبلغ 69.0 جم/مول. هذه هي كتلة مول واحد من NaNo2، وهي كمية المادة التي تحتوي على 6.02 × 10^23 جزيء فردي من المركب. الكتلة المولية هي خاصية فيزيائية مهمة تستخدم لحساب الخواص الكيميائية والفيزيائية المختلفة للمادة.
درجة غليان نتريت الصوديوم
نقطة غليان NaNo2 هي 320 درجة مئوية (608 درجة فهرنهايت). هذه هي درجة الحرارة التي يتحول عندها NaNo2 من سائل إلى غاز. تعتبر نقطة الغليان خاصية مهمة لأنها يمكن أن تؤثر على كيفية استخدام المادة في التطبيقات الصناعية المختلفة، مثل إنتاج الأصباغ والأصباغ والمواد الصيدلانية.
نقطة انصهار نتريت الصوديوم
نقطة انصهار NaNo2 هي 271 درجة مئوية (520 درجة فهرنهايت). هذه هي درجة الحرارة التي يتحول عندها NaNo2 من الحالة الصلبة إلى الحالة السائلة. تعتبر نقطة الانصهار خاصية مهمة لأنها يمكن أن تؤثر على استقرار المادة وتفاعلها عند درجات حرارة مختلفة.
كثافة نتريت الصوديوم جم/مل
تبلغ كثافة NaNo2 2.168 جم/مل. الكثافة هي الكتلة لكل وحدة حجم من المادة ويمكن استخدامها لتحديد تركيز المحلول. يمكن أيضًا استخدام كثافة NaNo2 لتحديد درجة نقاء العينة.
الوزن الجزيئي لنتريت الصوديوم
الوزن الجزيئي لـ NaNo2 هو 69.0 جم/مول. وهو مجموع الأوزان الذرية لجميع الذرات الموجودة في جزيء المركب. الوزن الجزيئي هو خاصية مهمة تستخدم لحساب الخواص الكيميائية والفيزيائية المختلفة للمادة.
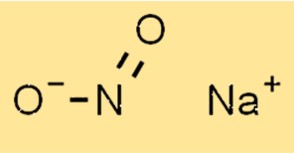
هيكل نتريت الصوديوم
يتكون هيكل NaNo2 من كاتيون الصوديوم (Na+) وأنيون النتريت (NO2-). يحتوي أنيون النتريت على هندسة مستوية مثلثية تحتوي على ذرة نيتروجين واحدة وذرتين أكسجين. يقع كاتيون الصوديوم في وسط أنيون النتريت.
ذوبان نتريت الصوديوم
NaNo2 قابل للذوبان في الماء، مع ذوبان 820 جم / لتر عند 20 درجة مئوية. الذوبانية هي أقصى كمية من المادة يمكن إذابتها في كمية معينة من المذيب عند درجة حرارة معينة. يمكن أن تتأثر قابلية ذوبان NaNo2 بعوامل مثل درجة الحرارة ووجود المواد المذابة الأخرى.
| مظهر | مسحوق بلوري أبيض إلى مصفر قليلاً |
| جاذبية معينة | 2,168 جم/مل |
| لون | أبيض إلى مصفر قليلا |
| يشم | عديم الرائحة |
| الكتلة المولية | 69.0 جرام/مول |
| كثافة | 2,168 جم/مل |
| نقطة الانصهار | 271 درجة مئوية (520 درجة فهرنهايت) |
| نقطة الغليان | 320 درجة مئوية (608 درجة فهرنهايت) |
| نقطة فلاش | غير قابل للتطبيق |
| الذوبان في الماء | 820 جم/لتر عند 20 درجة مئوية |
| الذوبان | قابل للذوبان في الإيثانول والجلسرين |
| ضغط البخار | 1.33 كيلو باسكال عند 20 درجة مئوية |
| كثافة بخار | 2.3 (الهواء = 1) |
| pKa | 3.34 |
| الرقم الهيدروجيني | 7-8 (محلول 10%) |
السلامة ومخاطر نتريت الصوديوم
يمكن أن يشكل NaNo2 عددًا من المخاطر على صحة الإنسان والبيئة. ويعتبر سامًا إذا تم تناوله أو استنشاقه أو امتصاصه عن طريق الجلد ويمكن أن يسبب ميتهيموغلوبينية الدم، وهي حالة يكون فيها الدم غير قادر على حمل الأكسجين إلى أنسجة الجسم. يمكن أن يكون NaNo2 أيضًا مهيجًا للعينين والجلد والجهاز التنفسي. من المهم التعامل مع NaNo2 بحذر، باستخدام معدات الحماية الشخصية المناسبة واتباع إجراءات التعامل والتخلص المناسبة. بالإضافة إلى ذلك، يمكن أن يشكل NaNo2 خطراً على البيئة إذا لم يتم احتواؤه والتخلص منه بشكل صحيح.
| رموز الخطر | تي +، ج |
| وصف الأمان | الابتعاد عن المواد القابلة للاحتراق. لا تتنفس الغبار / الأبخرة / الغاز / الضباب / الأبخرة / الرذاذ. ارتداء القفازات/الملابس الواقية وحماية العين/الوجه. في حالة نشوب حريق: استخدم ثاني أكسيد الكربون أو المسحوق الكيميائي أو الرغوة للإطفاء. تخلص من المحتويات/الحاوية وفقًا للوائح المحلية/الإقليمية/الوطنية/الدولية. |
| أرقام تعريف الأمم المتحدة | UN1500 |
| رمز النظام المنسق | 283410 |
| فئة الخطر | 5.1 |
| مجموعة التعبئة | ثانيا |
| تسمم | شديد السمية عند البلع والاستنشاق وامتصاص الجلد. قد يسبب ميتهيموغلوبينية الدم. مهيجة للعيون والجلد والجهاز التنفسي. |
طرق تصنيع نتريت الصوديوم
هناك عدة طرق لتجميع NaNo2.
إحدى الطرق الشائعة هي تفاعل حمض النيتريك وهيدروكسيد الصوديوم ، الذي ينتج نترات الصوديوم. يقوم عامل اختزال مثل الحديد أو الزنك باختزال نترات الصوديوم، مكونًا NaNo2.
تتضمن الطريقة الأخرى تفاعل نترات الصوديوم مع حمض الهيدروكلوريك ، لإنتاج خليط من حمض النيتريك وكلوريد الصوديوم. يتفاعل هيدروكسيد الصوديوم مع حمض النيتريك لإنتاج NaNo2.
يمكن أن يحدث تخليق NaNo2 من خلال التفاعل بين الأمونيا ونترات الصوديوم ، الذي ينتج NaNo2 والماء كمنتجات.
تنتج عملية تصنيع حمض النيتريك NaNo2 كمنتج ثانوي أثناء أكسدة الأمونيا في هذه العملية.
استخدامات نتريت الصوديوم
NaNo2 له استخدامات مختلفة في مختلف الصناعات، ومنها ما يلي:
- حفظ الطعام: يُستخدم عادة كمادة حافظة للأغذية، خاصة في اللحوم المعالجة مثل لحم الخنزير المقدد والنقانق. يساعد على منع نمو البكتيريا الضارة ويحافظ على لون ونكهة اللحوم.
- التطبيقات الصناعية: يستخدم في التطبيقات الصناعية المختلفة، مثل معالجة المعادن وكمانع للتآكل. تستخدم أيضا في إنتاج الأصباغ والمواد الكيميائية الأخرى.
- التطبيقات الطبية: يستخدم طبياً لعلاج التسمم بالسيانيد لأنه يحول الهيموجلوبين إلى ميتهيموجلوبين، والذي يمكن أن يرتبط بأيونات السيانيد ويمنعها من الارتباط بالهيموجلوبين.
- معالجة المياه: يستخدم في معالجة المياه للتحكم في نمو البكتيريا والطحالب الضارة في شبكات المياه.
- الزراعة: يستخدم في الزراعة كسماد، مما يساعد على تحسين إنتاجية المحاصيل وجودتها.
- التصوير الفوتوغرافي: يستخدم في التصوير الفوتوغرافي كعامل تطوير.
أسئلة:
س: ما هو نتريت الصوديوم؟
ج: NaNo2 مركب كيميائي صيغته NaNO2. وهو مسحوق بلوري أبيض أو أصفر قليلاً يستخدم عادة كمادة حافظة للأغذية وفي التطبيقات الصناعية المختلفة.
س: من هو مكتشف نتريت الصوديوم؟
ج: تم اكتشاف NaNO2 لأول مرة في عام 1805 من قبل الكيميائي الفرنسي لويس نيكولا فاوكيلين.
س: هل نتريت الصوديوم سيء بالنسبة لك؟
ج: الاستهلاك المفرط لـ NaNo2 يمكن أن يكون ضارًا بصحة الإنسان. وقد تم ربطه بمشاكل صحية مثل السرطان وميثيموغلوبينية الدم، وهو مرض يكون فيه الدم غير قادر على نقل الأكسجين بشكل فعال. ومع ذلك، عند استخدامه بكميات منظمة ومحدودة، يعتبر NaNo2 آمنًا للاستهلاك.
س: ما هي صيغة نتريت الصوديوم؟
ج: صيغة نتريت الصوديوم هي NaNO2.
س: هل نتريت الصوديوم آمن؟
ج: يعتبر NaNo2 بشكل عام آمنًا للاستهلاك عند استخدامه بكميات منظمة ومحدودة. ومع ذلك، فإن الاستهلاك المفرط يمكن أن يكون ضارا بصحة الإنسان.
س: كيفية صنع نتريت الصوديوم؟
ج: يمكن تصنيع NaNo2 بطرق مختلفة، مثل تفاعل حمض النيتريك وهيدروكسيد الصوديوم، وتفاعل نترات الصوديوم مع حمض الهيدروكلوريك، وتفاعل الأمونيا مع نترات الصوديوم. ومع ذلك، يجب أن يتم تصنيع NaNo2 بحذر، لأنه ينطوي على استخدام مواد كيميائية خطرة ويتطلب اتخاذ تدابير السلامة المناسبة.
س: هل نتريت الصوديوم مؤكسد؟
ج: نعم، NaNo2 مادة مؤكسدة. يستخدم عادة في الألعاب النارية كعامل مؤكسد.
س: كيف يؤثر نتريت الصوديوم على لون اللحوم؟
ج: يستخدم NaNO2 بشكل شائع كمادة حافظة للأغذية في اللحوم المعالجة مثل لحم الخنزير المقدد والنقانق. يساعد في الحفاظ على لون اللحوم عن طريق تثبيط نمو البكتيريا الضارة التي يمكن أن تسبب تغير اللون.
س: كيف يتم إنتاج NaNO2 وNaNO3 تجاريًا؟
ج: يتم إنتاج NaNO3 وNaNO2 تجارياً بطرق مختلفة، مثل أكسدة الأمونيا وتفاعل هيدروكسيد الصوديوم مع حمض النيتريك. ويتم استخدامها في مختلف التطبيقات الصناعية والطبية والزراعية، وكذلك في حفظ الأغذية.
