ميتابيسلفيت الصوديوم (Na2S2O5) هو مركب كيميائي يستخدم كمادة حافظة ومضاد للأكسدة في الأطعمة والمشروبات. ويمكن استخدامه أيضًا كمطهر ومبيض في مختلف الصناعات.
| اسم الأيوباك | بيروكبريتيت الصوديوم |
| الصيغة الجزيئية | Na2S2O5 |
| CAS رقم | 7681-57-4 |
| المرادفات | ثاني كبريتيت الصوديوم، حمض البيروكبريت، ملح ثنائي الصوديوم، بيروكبريتيت الصوديوم، ثاني كبريتيت الصوديوم |
| إنتشي | InChI=1S/2Na.H2O5S2/c;;1-6(2)7(3,4)5/h;;(H,1,2)(H,3,4,5)/q2*+1; /ص-2 |
خصائص ميتابيسلفيت الصوديوم
صيغة ميتابيسلفيت الصوديوم
الصيغة الكيميائية لميتابيسلفيت الصوديوم هي Na2S2O5. ويتكون من أيونين صوديوم (Na+) وأيون ثاني كبريتيت (S2O5-2). المركب عبارة عن مسحوق بلوري أبيض أو مصفر، قابل للذوبان في الماء وينبعث منه رائحة نفاذة.
ميتابيسلفيت الصوديوم الكتلة المولية
الكتلة المولية لـ Na2S2O5 هي 190.107 جم/مول. يتم حساب هذه القيمة عن طريق جمع الكتل الذرية للعناصر الموجودة في المركب، وهي 22.99 جم/مول للصوديوم، و32.06 جم/مول للكبريت، و15.99 جم/مول للأكسجين. الكتلة المولية هي خاصية مهمة تساعد في تحديد كمية المادة اللازمة للتفاعل الكيميائي.
نقطة غليان ميتابيسلفيت الصوديوم
Na2S2O5 له نقطة انصهار عالية تبلغ 150 درجة مئوية، لكنه يتحلل قبل أن يغلي. يتحلل المركب إلى ثاني أكسيد الكبريت (SO2) وكبريتيت الصوديوم (Na2SO3) عند درجة حرارة حوالي 150 درجة مئوية. لذلك، فإن نقطة غليان Na2S2O5 غير قابلة للتطبيق.
نقطة انصهار ميتابيسلفيت الصوديوم
درجة انصهار Na2S2O5 هي 150 درجة مئوية. عند درجة الحرارة هذه، يخضع المركب لتغير طوري من الحالة الصلبة إلى الحالة السائلة. تعتبر نقطة الانصهار خاصية فيزيائية مهمة تساعد في تحديد المادة وتوصيفها.
كثافة ميتابيسلفيت الصوديوم جم/مل
تبلغ كثافة Na2S2O5 1.48 جم/مل. وهو مركب كثيف نسبيا يغوص في الماء. كثافة المادة هي الكتلة لكل وحدة حجم وهي خاصية فيزيائية مهمة تساعد في تحديد كمية المادة الموجودة في حجم معين.
الوزن الجزيئي ميتابيسلفيت الصوديوم
الوزن الجزيئي لـ Na2S2O5 هو 190.107 جم / مول. وهو مجموع الأوزان الذرية لجميع الذرات الموجودة في المركب. يعد الوزن الجزيئي خاصية مهمة تساعد في حساب كمية المادة اللازمة للتفاعل الكيميائي.
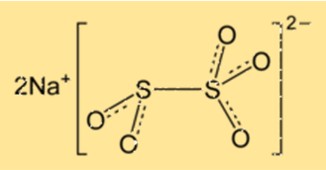
هيكل ميتابيسلفيت الصوديوم
يحتوي Na2S2O5 على بنية بلورية وينتمي إلى النظام البلوري المعيني. تتكون الشبكة البلورية من أيونات الصوديوم وأيونات ثاني كبريتيت مرتبة في نمط متكرر. يحتوي المركب على هندسة جزيئية رباعية السطوح، مع وجود ذرات الكبريت في وسط رباعي السطوح.
ذوبان ميتابيسلفيت الصوديوم
Na2S2O5 قابل للذوبان بدرجة عالية في الماء، مع قابلية ذوبان تبلغ 54 جم / 100 مل عند 25 درجة مئوية. كما أنه قابل للذوبان في الجلسرين وقابل للذوبان بشكل طفيف في الإيثانول. تعد قابلية ذوبان المادة خاصية مهمة تحدد قدرتها على الذوبان في مذيب معين.
| مظهر | مسحوق بلوري أبيض أو مصفر |
| جاذبية معينة | 1.48 |
| لون | أبيض إلى مصفر |
| يشم | فدان |
| الكتلة المولية | 190.107 جرام/مول |
| كثافة | 1.48 جرام/مل |
| نقطة الانصهار | 150 درجة مئوية |
| نقطة الغليان | ينهار قبل الغليان |
| نقطة فلاش | غير قابل للتطبيق |
| الذوبان في الماء | 54 جم/100 مل عند 25 درجة مئوية |
| الذوبان | قابل للذوبان في الجلسرين وقابل للذوبان بشكل طفيف في الإيثانول |
| ضغط البخار | غير متاح |
| كثافة بخار | غير متاح |
| pKa | 7.2 |
| الرقم الهيدروجيني | 4.5 (محلول 5%) |
السلامة ومخاطر ميتابيسلفيت الصوديوم
يمكن أن يكون Na2S2O5 خطيرًا إذا لم يتم التعامل معه بشكل صحيح. وهو عامل اختزال قوي قد يسبب تهيج الجلد والعينين والجهاز التنفسي عند التعرض له. قد يسبب تناول المركب اضطرابًا خطيرًا في الجهاز الهضمي. يجب تخزين Na2S2O5 في منطقة باردة وجافة وجيدة التهوية بعيدًا عن المواد غير المتوافقة. لا ينبغي خلطه مع الأحماض القوية أو المؤكسدات القوية أو عوامل الاختزال. وينبغي استخدام معدات الحماية، مثل القفازات والنظارات الواقية وأجهزة التنفس، عند التعامل مع المركب. ينبغي أن تكون تدابير الطوارئ، مثل محطات غسل العين وطفايات الحريق، متاحة بسهولة في حالة وقوع حادث.
| رموز الخطر | شي (مزعج) |
| وصف الأمان | تجنب ملامسة الجلد والعينين. ارتداء ملابس واقية وقفازات. لا يبتلع. استخدم مع التهوية الكافية. |
| أرقام تعريف الأمم المتحدة | رقم الأمم المتحدة 2676 |
| رمز النظام المنسق | 2832.10.00 |
| فئة الخطر | 8 (المواد المسببة للتآكل) |
| مجموعة التعبئة | ثالثا |
| تسمم | الجرعة المميتة 50 (عن طريق الفم، للفئران): 1000 ملغم/كغم؛ التركيز المميت 50 (الاستنشاق، الفئران): 11 ملغم/لتر (4 ساعات) |
طرق تخليق ميتابيسلفيت الصوديوم
يمكن تصنيع Na2S2O5 بطرق مختلفة، بما في ذلك تفاعل ثنائي كبريتيت الصوديوم مع ثاني أكسيد الكبريت في وجود عامل مؤكسد مثل بيروكسيد الهيدروجين . تقوم العملية بتسخين إضافة ثنائي كبريتيت الصوديوم وثاني أكسيد الكبريت لتكوين Na2S2O5.
تتضمن الطريقة الأخرى تفاعل هيدروكسيد الصوديوم مع غاز ثاني أكسيد الكبريت، ثم إضافة حمض الكبريتيك لتكوين كبريتات الصوديوم وNa2S2O5.
تتضمن طريقة التصنيع الأخرى تفاعل كربونات الصوديوم مع ثاني أكسيد الكبريت ثم تسخين كبريتيت الصوديوم الناتج في وجود الهواء. تنتج هذه العملية كبريتات الصوديوم وNa2S2O5.
في وجود عامل مؤكسد مثل بيروكسيد الهيدروجين أو حمض النيتريك، يمكن تحضير Na2S2O5 عن طريق تفاعل الكبريت مع كبريتيت الصوديوم.
في الصناعة، الطريقة الأكثر شيوعًا لتخليق Na2S2O5 هي تفاعل ثنائي كبريتيت الصوديوم مع ثاني أكسيد الكبريت في وجود محفز مثل ثاني أكسيد المنغنيز. تسخين ثنائي كبريتيت الصوديوم/مقارب ثاني أكسيد الكبريت يشكل Na2S2O5.
استخدامات ميتابيسلفيت الصوديوم
Na2S2O5 له استخدامات مختلفة في العديد من الصناعات بسبب خصائصه الاختزالية القوية وقدرته على العمل كمادة حافظة ومضاد للأكسدة. تتضمن بعض الاستخدامات الشائعة لـ Na2S2O5 ما يلي:
- صناعة الأغذية والمشروبات: تستخدم على نطاق واسع كمادة حافظة ومضادة للأكسدة في منتجات الأغذية والمشروبات مثل النبيذ والبيرة وعصائر الفاكهة والفواكه المجففة. وهذا يساعد على منع تلف وأكسدة هذه المنتجات، وبالتالي إطالة مدة صلاحيتها.
- الصناعة الدوائية: يستخدم كمضاد للأكسدة في المنتجات الصيدلانية المختلفة مثل الكريمات والمراهم والأقراص. فهو يساعد على منع تدهور هذه المنتجات بسبب التعرض للهواء والضوء.
- معالجة المياه: تستخدم لإزالة الكلور من المياه في محطات معالجة المياه. فهو يساعد على التخلص من الكلور والكلورامينات الزائدة، والتي يمكن أن تكون ضارة للحياة المائية.
- التصوير الفوتوغرافي: يستخدم كمطور ومثبت للصور الفوتوغرافية في صناعة التصوير الفوتوغرافي. يساعد على تحويل أيونات الفضة إلى فضة معدنية، وبالتالي تكوين الصورة الفوتوغرافية.
- صناعة النسيج: يستخدم كعامل اختزال في صناعة النسيج في عمليات الصباغة والطباعة. فهو يساعد على إزالة الأكسجين الزائد من محلول الصبغة، مما يحسن كثافة اللون وتوحيده.
أسئلة:
س: أين يمكنني شراء ميتابيسلفيت الصوديوم محليا؟
ج: يمكن عادةً العثور على Na2S2O5 في متاجر المواد الكيميائية أو تجار التجزئة عبر الإنترنت. وقد يكون متاحًا أيضًا في بعض متاجر الأطعمة المتخصصة، حيث يُستخدم بشكل شائع كمادة حافظة في صناعة المواد الغذائية.
س: أين يمكن شراء ميتابيسلفيت الصوديوم؟
ج: يمكن شراء Na2S2O5 من متاجر المواد الكيميائية أو من تجار التجزئة للمواد الكيميائية المتخصصة عبر الإنترنت. وقد يكون متاحًا أيضًا في بعض متاجر الأطعمة المتخصصة.
س: هل ميتابيسلفيت الصوديوم آمن؟
ج: يمكن أن يكون Na2S2O5 خطيرًا إذا لم يتم التعامل معه بشكل صحيح. من المهم ارتداء معدات الحماية المناسبة واتباع احتياطات السلامة عند التعامل مع هذا المركب. يمكن أن يسبب تهيج الجلد والعين ويمكنه أيضًا إطلاق ثاني أكسيد الكبريت السام إذا تم خلطه بالحمض. ومع ذلك، عند استخدامه بتركيزات مناسبة والتعامل معه بحذر، يعتبر Na2S2O5 آمنًا بشكل عام للاستخدامات المقصودة.
س: هل يمكنك تحويل ثنائي كبريتات الصوديوم إلى ميتابيسلفيت الصوديوم؟
ج: نعم، يمكن تحويل ثنائي كبريتات الصوديوم (NaHSO4) إلى Na2S2O5 عن طريق تسخينه إلى درجة حرارة عالية في وجود عامل مؤكسد، مثل بيروكسيد الهيدروجين. وينتج عن التفاعل إطلاق الماء وتكوين Na2S2O5.
س: ما هو الفرق بين ثنائي كبريتيت الصوديوم وميتابيسلفيت الصوديوم؟
ج: الفرق الرئيسي بين NaHSO3 وNa2S2O5 هو تركيبهما الكيميائي. يحتوي ثنائي كبريتيت الصوديوم على مجموعة كبريتيت واحدة (-SO3) وأيون هيدروجين واحد (H+)، بينما يحتوي Na2S2O5 على مجموعتي كبريتيت (-SO3) مرتبطتين معًا. كما أن Na2S2O5 أكثر استقرارًا وله مدة صلاحية أطول من ثنائي كبريتيت الصوديوم.
س: ما هو عدد تأكسد S في Na2S2O5 ؟
ج: عدد تأكسد الكبريت (S) في Na2S2O5 هو +5.
س: كيف يمكن العثور على تركيز IO3- من KIO3 وNa2S2O5؟
ج: يمكن تحديد تركيز IO3- عن طريق المعايرة بتركيز معروف من ثيوكبريتات الصوديوم (Na2S2O3)، باستخدام النشا كمؤشر. التفاعل بين KIO3 وNa2S2O5 ينتج اليود (I2)، الذي يتفاعل مع Na2S2O3 لتكوين NaI وNa2S4O6. من خلال قياس حجم Na2S2O3 اللازم للتفاعل مع اليود، يمكن حساب تركيز IO3-.
س: ما الأيونات التي تحتوي عليها Na2S2O5؟
ج: يتكون Na2S2O5 من أيونين صوديوم (Na+) وأيون ثاني كبريتيت (-S2O5).
