كلوريد المغنيسيوم (MgCl2) هو مركب يتكون من أيونات المغنيسيوم والكلوريد. يستخدم بشكل شائع كمكمل لعلاج نقص المغنيسيوم وكمزيل للجليد من الطرق والأرصفة.
| اسم الأيوباك | كلوريد الماغنيسيوم |
| الصيغة الجزيئية | ملغكل2 |
| CAS رقم | 7786-30-3 |
| المرادفات | ثنائي كلوريد المغنيسيوم، كلوروماغنيزيت، ثنائي كلوروماغنيسيوم، كلوريد المغنيسيوم (II)، E511، نيجاري |
| إنتشي | InChI=1S/2ClH.Mg/h2*1H;/q;;+2/p-2 |
صيغة كلوريد المغنيسيوم
الصيغة الكيميائية لكلوريد المغنيسيوم هي MgCl2. تشير هذه الصيغة إلى أن كلوريد المغنيسيوم يتكون من أيون Mg+2 واحد وأيونات Cl-. الصيغة مهمة في تحديد كمية كلوريد المغنيسيوم اللازمة للتفاعلات الكيميائية. يستخدم كلوريد المغنيسيوم بشكل شائع كمكمل لعلاج نقص المغنيسيوم وكمزيل للجليد من الطرق والأرصفة.
الكتلة المولية لكلوريد المغنيسيوم
الكتلة المولية لكلوريد المغنيسيوم هي 95.21 جم / مول. وهو مركب بلوري يتكون من أيون Mg+2 واحد وأيونات Cl-. الكتلة المولية هي خاصية مهمة لكلوريد المغنيسيوم لأنها تستخدم لحساب كمية المادة في التفاعلات الكيميائية. يستخدم كلوريد المغنيسيوم بشكل شائع كمكمل لعلاج نقص المغنيسيوم وكمزيل للجليد من الطرق والأرصفة.
نقطة غليان MgCl2
يحتوي MgCl2 على نقطة غليان عالية تبلغ 1412 درجة مئوية، مما يعني أنه يتطلب الكثير من الطاقة لكسر الروابط بين ذراته وجزيئاته. هذه الخاصية تجعلها مفيدة في تطبيقات درجات الحرارة العالية، مثل إنتاج المعادن والسبائك. يستخدم MgCl2 أيضًا كمجفف لامتصاص الرطوبة من الهواء وكمحفز في التفاعلات الكيميائية.
نقطة انصهار MgCl2
نقطة انصهار MgCl2 هي 714 درجة مئوية، مما يعني أنه مادة صلبة في درجة حرارة الغرفة. هذه الخاصية تجعله مفيدًا في العديد من التطبيقات، مثل إنتاج معدن المغنيسيوم وكتدفق في لحام الألومنيوم. يستخدم MgCl2 أيضًا كمخثر في إنتاج التوفو ومنتجات الصويا الأخرى.
الكثافة MgCl2 جم/مل
تبلغ كثافة MgCl2 2.32 جم/مل. هذه الخاصية تجعلها مفيدة في تطبيقات مختلفة، مثل إنتاج المواد المثبطة للهب ومعالجة مياه الصرف الصحي. يستخدم MgCl2 أيضًا كمادة مثبطة للغبار على الطرق وفي بناء الطرق السريعة.
الوزن الجزيئي لـ MgCl2
الوزن الجزيئي لـ MgCl2 هو 95.21 جم/مول. هذه الخاصية مهمة لتحديد كمية MgCl2 اللازمة للتفاعلات الكيميائية. يستخدم MgCl2 بشكل شائع كمكمل لعلاج نقص المغنيسيوم وكمزيل للجليد عن الطرق والأرصفة.
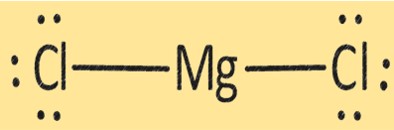
هيكل MgCl2
يحتوي MgCl2 على بنية بلورية تتكون من أيون Mg+2 واحد وأيونات Cl-. إن بنية MgCl2 مهمة في تحديد خواصه الفيزيائية والكيميائية. يستخدم MgCl2 في تطبيقات مختلفة، مثل إنتاج معدن المغنيسيوم، كمجفف، وكمخثر في إنتاج التوفو ومنتجات الصويا الأخرى.
| مظهر | مادة صلبة بلورية بيضاء |
| جاذبية معينة | 2.32 جم/مل |
| لون | أبيض |
| يشم | عديم الرائحة |
| الكتلة المولية | 95.21 جرام/مول |
| كثافة | 2.32 جم/مل |
| نقطة الانصهار | 714 درجة مئوية |
| نقطة الغليان | 1412 درجة مئوية |
| نقطة فلاش | غير قابل للتطبيق |
| الذوبان في الماء | قابل للذوبان للغاية |
| الذوبان | قابل للذوبان في الماء والإيثانول والميثانول |
| ضغط البخار | غير قابل للتطبيق |
| كثافة بخار | غير قابل للتطبيق |
| pKa | 7.6 (لأيونات Mg(H2O)6^2+) |
| الرقم الهيدروجيني | 6.0 – 8.0 |
سلامة ومخاطر كلوريد المغنيسيوم
يعتبر كلوريد المغنيسيوم (MgCl2) آمنًا بشكل عام عند استخدامه وفقًا للتعليمات. ومع ذلك، يمكن أن تشكل بعض المخاطر إذا لم يتم التعامل معها بشكل صحيح. قد يسبب تهيج الجلد والعينين، كما أن استنشاق الغبار قد يسبب مشاكل في الجهاز التنفسي. تناول كميات كبيرة من MgCl2 يمكن أن يسبب الغثيان والقيء والإسهال. كما يمكن أن يكون ضارًا بالحياة المائية إذا تم إطلاقه في المجاري المائية. يجب ارتداء معدات الحماية المناسبة، مثل القفازات والنظارات الواقية، عند التعامل مع MgCl2. يجب احتواء أي انسكابات أو إطلاقات وتنظيفها على الفور لتجنب الأضرار البيئية.
| رموز الخطر | لم يتم تعيين أي شيء |
| وصف الأمان | تجنب ملامسة الجلد والعينين. في حالة ملامسته، اشطفيه بالماء. ارتداء القفازات والنظارات الواقية عند التعامل. |
| أرقام تعريف الأمم المتحدة | واحد 2019 |
| رمز النظام المنسق | 28273100 |
| فئة الخطر | 8 |
| مجموعة التعبئة | ثالثا |
| تسمم | LD50 (عن طريق الفم، الفئران) – 4640 ملغم / كغم؛ التركيز المميت للنصف (الاستنشاق، الفئران) – أكبر من 4.4 ملغم/لتر لمدة 4 ساعات |
طرق تصنيع كلوريد المغنيسيوم
يمكن لطرق مختلفة تصنيع MgCl2، بما في ذلك التخليق المباشر، والتفاعل مع حمض الهيدروكلوريك ، والتفاعل مع MgO.
لإنتاج MgCl2 عن طريق التخليق المباشر، قم بحرق معدن المغنيسيوم في الهواء أو غاز الكلور لتكوين MgO. بعد ذلك، قم بتفاعل MgO مع حمض الهيدروكلوريك لإنتاج MgCl2:
ملغ + O2 → أهداب الشوق
أهداب الشوق + 2HCl → MgCl2 + H2O
تتضمن الطريقة الأخرى تفاعل المعدن Mg مع حمض الهيدروكلوريك لإنتاج MgCl2 وغاز الهيدروجين:
ملغ + 2HCl → ملغكل2 + H2
للتفاعل مع MgO، نقوم بخلط MgO مع حمض الهيدروكلوريك لإنتاج MgCl2 والماء:
أهداب الشوق + 2HCl → MgCl2 + H2O
خلط MgO مع حمض الهيدروكلوريك ينتج كلوريد المغنيسيوم والماء عند التفاعل مع MgO:
Mg(OH)2 + 2HCl → MgCl2 + 2H2O
بالإضافة إلى ذلك، يمكننا الحصول على “MgCl” _2 كمنتج ثانوي لعملية “سولفاي”، التي تنتج كربونات الصوديوم . تؤدي هذه العملية إلى إنتاج كلوريد الكالسيوم وMgCl2 كمنتجات ثانوية يمكن فصلها عن محلول كربونات الصوديوم.
استخدامات كلوريد المغنيسيوم
كلوريد المغنيسيوم لديه مجموعة واسعة من الاستخدامات في مختلف الصناعات، بما في ذلك:
- عامل التذويب: يستخدم كعامل تذويب على الطرق والأرصفة خلال أشهر الشتاء لقدرته على خفض درجة تجمد الماء.
- التحكم في الغبار: يستخدم كعامل للتحكم في الغبار على الطرق غير المعبدة ومواقع البناء.
- صناعة المواد الغذائية: يستخدم كمادة تخثر في إنتاج التوفو وكمصدر للمغنيسيوم في بعض المنتجات الغذائية.
- الطب: يستخدم طبياً كمكمل لنقص المغنيسيوم وكعلاج لحالات معينة، مثل الإمساك وحرقة المعدة.
- الزراعة: يستخدم كسماد ومحسن للتربة لتحسين محتوى التربة من المغنيسيوم ونمو النباتات.
- معالجة المياه: يستخدم في عمليات معالجة المياه لإزالة الشوائب وتليين الماء العسر.
- التطبيقات الصناعية: يستخدم في إنتاج المنسوجات والورق والأسمنت، وكذلك في العمليات الصناعية المختلفة.
- الصحة والعافية: يستخدم في مختلف ممارسات الصحة والعافية، مثل الاستحمام، لتعزيز الاسترخاء وتحسين صحة الجلد.
أسئلة:
س: ما هي صيغة كلوريد المغنيسيوم؟
ج: صيغة كلوريد المغنيسيوم هي MgCl2.
س: ما هو كلوريد المغنيسيوم؟
ج: MgCl2 هو مركب غير عضوي يستخدم بشكل شائع في العديد من الصناعات والتطبيقات، بما في ذلك كعامل إزالة الجليد، وعامل التحكم في الغبار، والمواد المضافة للأغذية.
س: هل كلوريد المغنيسيوم قابل للذوبان؟
ج: نعم، MgCl2 قابل للذوبان في الماء والمذيبات القطبية الأخرى.
س: هل كلوريد المغنيسيوم أيوني أم تساهمي؟
ج: MgCl2 مركب أيوني يتكون من كاتيون (Mg2+) وأنيون (Cl-).
س: ما هو MgCl2؟
ج: MgCl2 هي الصيغة الكيميائية لكلوريد المغنيسيوم، وهو مركب غير عضوي يستخدم في مختلف التطبيقات الصناعية والاستهلاكية.
س: ما المعادلة الأيونية الصافية لتفاعل MgCl2 مع NaOH؟
ج: المعادلة الأيونية الصافية لتفاعل MgCl2 مع NaOH هي Mg2+ (aq) + 2OH- (aq) → Mg(OH)2(s).
