كلوريد البوتاسيوم (KCl) هو مركب يحتوي على البوتاسيوم والكلور. يتم استخدامه كسماد ومضاف غذائي وعلاج طبي لمستويات البوتاسيوم المنخفضة. ويمكن استخدامه أيضًا في الحقن المميتة.
| اسم الأيوباك | كلوريد البوتاسيوم |
| الصيغة الجزيئية | بوكل |
| CAS رقم | 7447-40-7 |
| المرادفات | بوكل، كاليوم كلوراتوم، موريات البوتاس، سيلفيت، كلوروبوتاسوريل، كاليتابس، كلوتريكس، كلور-كون، ك-دور |
| إنتشي | InChI=1S/ClH.K/h1H;/q;+1/p-1 |
صيغة كلوريد البوتاسيوم
الصيغة الكيميائية لكلوريد البوتاسيوم هي KCl. وهو مركب ثنائي يتكون من ذرة بوتاسيوم واحدة وذرة كلور واحدة. تعتبر صيغة كلوريد البوتاسيوم مهمة لفهم خواصه الكيميائية ولإجراء الحسابات المتعلقة باستخدامه في التطبيقات المختلفة.
الكتلة المولية لكلوريد البوتاسيوم
الكتلة المولية لـ KCl هي 74.55 جم / مول. وهي مادة صلبة بلورية بيضاء ذات طعم مالح وقابلة للذوبان بدرجة عالية في الماء. KCl مركب يتكون من ذرة بوتاسيوم واحدة وذرة كلور واحدة.
نقطة غليان كلوريد البوتاسيوم
نقطة غليان KCl هي 1420 درجة مئوية (2588 درجة فهرنهايت). وهو مركب ذو درجة انصهار عالية ويتطلب طاقة كبيرة للوصول إلى نقطة الغليان. نقطة الغليان العالية لـ KCl تجعله مفيدًا في تطبيقات درجات الحرارة المرتفعة، مثل إنتاج السيراميك والزجاج.
نقطة انصهار KCl
نقطة انصهار KCl هي 770 درجة مئوية (1418 درجة فهرنهايت). وهو مركب ذو نقطة انصهار عالية نسبيًا ويتطلب حرارة كبيرة حتى يذوب. يستخدم KCl في إنتاج الأسمدة وتساعد نقطة انصهاره العالية على ضمان ثباته عند درجات الحرارة المرتفعة.
كثافة بوكل جم/مل
تبلغ كثافة بوكل 1.98 جم/سم3. وهو مركب كثيف نسبيا، وهذا يعني أن كمية صغيرة تحتوي على عدد كبير من الجزيئات. الكثافة العالية لـ KCl تجعله مفيدًا في بعض التطبيقات الصناعية، مثل إنتاج سوائل الحفر.
الوزن الجزيئي لـ KCl
الوزن الجزيئي لـ KCl هو 74.55 جم / مول. وهو مركب خفيف نسبيا، وهذا يعني أنه يحتوي على عدد صغير من الجزيئات. الوزن الجزيئي المنخفض لـ KCl يجعل من السهل نقله والتعامل معه في البيئات الصناعية.
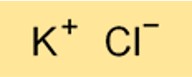
هيكل بوكل
هيكل KCl عبارة عن شبكة بلورية أيونية. وهو يتألف من أيونات البوتاسيوم والكلور المتناوبة مرتبة في نمط متكرر. الطبيعة الأيونية للهيكل تعني أن KCl موصل جيد للكهرباء عندما يذوب في الماء.
| مظهر | مادة صلبة بلورية بيضاء |
| جاذبية معينة | 1.98 جم/سم3 |
| لون | عديم اللون إلى الأبيض |
| يشم | عديم الرائحة |
| الكتلة المولية | 74.55 جرام/مول |
| كثافة | 1.98 جم/سم3 |
| نقطة الانصهار | 770 درجة مئوية (1418 درجة فهرنهايت) |
| نقطة الغليان | 1420 درجة مئوية (2588 درجة فهرنهايت) |
| نقطة فلاش | غير قابل للتطبيق |
| الذوبان في الماء | 34.7 جم/100 مل (0 درجة مئوية) |
| الذوبان | قابل للذوبان في الماء، الجلسرين والفورماميد. قابل للذوبان بشكل طفيف في الإيثانول |
| ضغط البخار | ضئيلة |
| كثافة بخار | غير قابل للتطبيق |
| pKa | -1.8 (حمض مترافق) |
| الرقم الهيدروجيني | 7 (محلول 10%) |
سلامة ومخاطر كلوريد البوتاسيوم
يحتوي كلوريد البوتاسيوم (KCl) على مخاطر محتملة ومخاوف تتعلق بالسلامة يجب أخذها في الاعتبار عند التعامل معه أو استخدامه. قد يتسبب ذلك في تهيج الجلد والعين، وقد يؤدي التعرض لفترة طويلة إلى حروق كيميائية. استنشاق غبار KCl قد يسبب تهيج الجهاز التنفسي والسعال. بالإضافة إلى ذلك، يمكن أن يؤدي تناول كميات كبيرة من KCl إلى اختلال توازن الإلكتروليت وعدم انتظام ضربات القلب. من المهم ارتداء معدات الحماية الشخصية المناسبة، مثل القفازات وحماية العين، والتعامل مع بوكل في منطقة جيدة التهوية. في حالة ملامسة الجلد أو العينين، من المهم شطف المنطقة المصابة جيدًا واستشارة الطبيب إذا لزم الأمر.
| رموز الخطر | لا أحد |
| وصف الأمان | يسبب تهيج الجلد والعين. ضارة إذا ابتلعت. |
| معرف | UN1480 |
| رمز النظام المنسق | 310420 |
| فئة الخطر | 5.1 |
| مجموعة التعبئة | ثانيا |
| تسمم | الجرعة المميتة 50 (الفئران، عن طريق الفم): 2500 ملغم/كغم |
طرق تصنيع كلوريد البوتاسيوم
هناك عدة طرق يمكن من خلالها تصنيع كلوريد البوتاسيوم (KCl)، بما في ذلك:
- الذوبان والتبلور: تتضمن هذه الطريقة إذابة كلوريد البوتاسيوم في الماء ثم السماح للمحلول بالتبخر، تاركًا وراءه بلورات كلوريد البوتاسيوم الصلبة.
- التبادل الأيوني: لإنتاج كلوريد البوتاسيوم، يمكن تبادل الأيونات الموجودة في محلول ملح آخر، مثل كلوريد الصوديوم، مع أيونات البوتاسيوم. تستخدم الصناعات عادةً هذه الطريقة في إنتاج أسمدة KCl.
- التحليل الكهربائي: التحليل الكهربائي لمحلول KCl ينتج عنه عنصر البوتاسيوم وغاز الكلور، والذي يتحد لتكوين KCl.
- تفاعل هيدروكسيد البوتاسيوم مع حمض الهيدروكلوريك : يمكن أن يتفاعل هيدروكسيد البوتاسيوم مع حمض الهيدروكلوريك لإنتاج كلوريد البوتاسيوم والماء.
- تفاعل كربونات البوتاسيوم مع حمض الهيدروكلوريك: يمكن أن تتفاعل كربونات البوتاسيوم مع حمض الهيدروكلوريك لإنتاج كلوريد البوتاسيوم وثاني أكسيد الكربون والماء.
ولكل طريقة مزاياها وعيوبها، واختيار الطريقة قد يعتمد على عوامل مثل النقاء المطلوب للمنتج، وحجم الإنتاج، وتكلفة المواد الخام والمعدات.
استخدامات كلوريد البوتاسيوم
كلوريد البوتاسيوم لديه مجموعة واسعة من الاستخدامات، بما في ذلك:
- الأسمدة: تستخدم كسماد لتوفير العناصر الغذائية الأساسية لنمو النبات.
- المضافات الغذائية: تستخدم كبديل للملح في الأطعمة المصنعة لتقليل تناول الصوديوم.
- معالجة المياه: تضاف إلى أنظمة معالجة المياه لمنع التآكل وتكوين القشور.
- التطبيقات الطبية: يستخدم في السوائل الوريدية ومحاليل معالجة الجفاف عن طريق الفم لاستبدال الشوارد وعلاج حالات مثل نقص بوتاسيوم الدم.
- التطبيقات الصناعية: يستخدم في إنتاج الزجاج والسيراميك والصابون، وكمادة خام في إنتاج المواد الكيميائية الأخرى.
- علف الحيوان: يضاف إلى علف الحيوان لتوفير العناصر الغذائية الأساسية.
- عامل التذويب: يستخدم كعامل تذويب لإذابة الجليد والثلج على الطرق والأرصفة.
- حفر النفط والغاز: يستخدم كمثبت للطين في عمليات حفر النفط والغاز.
- الكاشف المعملي: يستخدم ككاشف في التجارب والتحاليل المخبرية.
أسئلة:
س: ما هو كلوريد البوتاسيوم؟
ج: كلوريد البوتاسيوم (KCl) هو ملح بلوري أبيض يتكون من أيونات البوتاسيوم والكلور. لديها العديد من التطبيقات في صناعات مثل الزراعة والغذاء والدواء والتصنيع الكيميائي.
س: ما هو كلوريد البوتاسيوم المستخدم؟
ج: يستخدم كلوريد البوتاسيوم عادة كأسماد، ومضافات غذائية، وفي التطبيقات الطبية لعلاج حالات مثل نقص بوتاسيوم الدم. ويمكن استخدامه أيضًا في معالجة المياه والعمليات الصناعية وتغذية الحيوانات وإزالة الجليد والتنقيب عن النفط والغاز والتجارب المعملية.
س: هل كلوريد البوتاسيوم آمن؟
ج: يمكن أن يكون كلوريد البوتاسيوم ضارًا إذا تم تناوله بكميات كبيرة أو إذا لامس العين أو الجلد. من المهم اتباع إرشادات ولوائح السلامة المناسبة عند التعامل مع كلوريد البوتاسيوم أو استخدامه.
س: هل KCl قابل للذوبان في الماء؟
ج: نعم، بوكل قابل للذوبان بدرجة عالية في الماء. في درجة حرارة الغرفة، يمكن أن يذوب جرام واحد من KCl في 1.5 مل من الماء.
س: هل KCl أيوني أم تساهمي؟
ج: KCl مركب أيوني لأنه يتكون من أيونات بوتاسيوم موجبة الشحنة وأيونات كلوريد سالبة الشحنة ترتبط ببعضها بواسطة روابط أيونية.
س: هل KCl حمض أم قاعدة؟
ج: كلوريد البوتاسيوم مركب متعادل وليس حمضاً ولا قاعدة.
س: هل KCl إلكتروليت قوي؟
ج: نعم، يعتبر KCl إلكتروليتًا قويًا لأنه يتفكك تمامًا إلى أيونات البوتاسيوم والكلوريد عند ذوبانه في الماء، مما يسمح بالتوصيل الكهربائي.
