كلورات المغنيسيوم (Mg(ClO3)2) مركب يتكون من أيونات Mg2+ وClO3-. وهو مسحوق بلوري أبيض قابل للذوبان في الماء وشديد التفاعل. ويمكن استخدامه كعامل مؤكسد في إنتاج الألعاب النارية وكمطهر في معالجة المياه.
| اسم الأيوباك | كلورات المغنيسيوم |
| الصيغة الجزيئية | ملغ (ClO3)2 |
| CAS رقم | 10326-21-3 |
| المرادفات | ثنائي بيركلورات المغنيسيوم، كلورات المغنيسيوم (II)، كلورات المغنيسيوم سداسي هيدرات |
| إنتشي | InChI=1S/2ClHO3.Mg/c2 2-1(3)4;/h2 (H,2,3,4);/q;;+2/p-2 |
خصائص كلورات المغنيسيوم
صيغة كلورات المغنيسيوم
كلورات المغنيسيوم مركب كيميائي له الصيغة Mg(ClO3)2. يتكون المركب من أيون مغنيسيوم واحد (Mg2+) وأيونات ClO3. تنص الصيغة الكيميائية على أن جزيء واحد من كلورات المغنيسيوم يحتوي على أيوني كلوريد وست ذرات أكسجين.
كلورات المغنيسيوم الكتلة المولية
الكتلة المولية لـ Mg(ClO3)2 هي 191.2 جم/مول. يتم حساب هذه القيمة عن طريق إضافة الأوزان الذرية للعناصر الموجودة في جزيء Mg(ClO3)2. يحتوي المغنيسيوم على كتلة مولية تبلغ 24.31 جم / مول، بينما تبلغ الكتلة المولية للكلور والأكسجين 35.45 جم / مول و 16.00 جم / مول على التوالي. وبضرب الكتلة المولية لكل عنصر في عدد ذرات ذلك العنصر في الجزيء وإضافتها، نحصل على الكتلة المولية للمركب.
نقطة غليان كلورات المغنيسيوم
يتحلل Mg(ClO3)2 قبل أن يصل إلى نقطة الغليان. عند تسخينه، يتحلل Mg(ClO3)2 إلى كلوريد المغنيسيوم، وغاز الأكسجين، وغاز الكلور. ولذلك، فإن Mg(ClO3)2 ليس له نقطة غليان.
نقطة انصهار كلورات المغنيسيوم
درجة انصهار Mg(ClO3)2 هي 105 درجة مئوية. عند درجة الحرارة هذه، يتحول المركب الصلب إلى الحالة السائلة. يمكن أن تختلف نقطة انصهار Mg(ClO3)2 اعتمادًا على نقاء المركب والظروف التي يتم قياسه فيها.
كثافة كلورات المغنيسيوم جم/مل
تبلغ كثافة Mg(ClO3)2 2.21 جم/مل. وهذا يعني أن الملليلتر الواحد من Mg(ClO3)2 له كتلة 2.21 جرام. يمكن استخدام كثافة Mg(ClO3)2 لحساب حجم كتلة معينة من المركب أو كتلة حجم معين من المركب.
كلورات المغنيسيوم الوزن الجزيئي
الوزن الجزيئي لـ Mg(ClO3)2 هو 191.2 جم/مول. يتم حساب هذه القيمة عن طريق إضافة الأوزان الذرية للعناصر الموجودة في جزيء Mg(ClO3)2.
هيكل كلورات المغنيسيوم
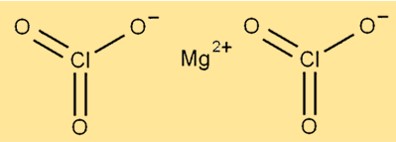
يتكون هيكل Mg(ClO3)2 من أيونات المغنيسيوم محاطة بست ذرات أكسجين وذرتين من الكلور. يقع أيون المغنسيوم في مركز الجزيء، بينما تتوزع ذرات الأكسجين والكلور حوله. يحتوي المركب على هيكل بلوري وهو أبيض اللون.
ذوبان كلورات المغنيسيوم
Mg(ClO3)2 قابل للذوبان في الماء والإيثانول والأسيتون. تزداد قابلية ذوبان Mg(ClO3)2 في الماء مع زيادة درجة الحرارة. في درجة حرارة الغرفة، يمكن أن يذوب حوالي 31 جرامًا من Mg(ClO3)2 في 100 مل من الماء. تعتمد قابلية ذوبان Mg(ClO3)2 في المذيبات الأخرى على قطبية المذيب.
| مظهر | مسحوق بلوري أبيض |
| جاذبية معينة | 2.21 جم/سم3 |
| لون | أبيض |
| يشم | عديم الرائحة |
| الكتلة المولية | 191.2 جرام/مول |
| كثافة | 2.21 جم/مل |
| نقطة الانصهار | 105 درجة مئوية |
| نقطة الغليان | ينهار قبل الغليان |
| نقطة فلاش | غير قابل للتطبيق |
| الذوبان في الماء | قابل للذوبان |
| الذوبان | قابل للذوبان في الماء والإيثانول والأسيتون |
| ضغط البخار | غير قابل للتطبيق |
| كثافة بخار | غير قابل للتطبيق |
| pKa | غير قابل للتطبيق |
| الرقم الهيدروجيني | غير قابل للتطبيق |
سلامة ومخاطر كلورات المغنيسيوم
يعتبر Mg(ClO3)2 عامل مؤكسد قوي ويمكن أن يتفاعل بعنف مع المواد القابلة للاحتراق، مما يسبب حرائق أو انفجارات. وقد يسبب أيضًا تهيجًا للجلد والعينين والجهاز التنفسي عند ملامسته أو استنشاقه. لذلك، يجب استخدام معدات الحماية الشخصية المناسبة، مثل القفازات والنظارات الواقية، عند التعامل مع Mg(ClO3)2. ويجب أيضًا تخزين المركب بعيدًا عن المواد القابلة للاحتراق ومصادر الحرارة أو الاشتعال. بالإضافة إلى ذلك، يجب توفير التهوية الكافية لمنع استنشاق الغبار أو البخار من المجمع. يجب التعامل مع Mg(ClO3)2 بحذر لتجنب المخاطر المحتملة.
| رموز الخطر | مؤكسد |
| وصف الأمان | تجنب ملامسة المواد القابلة للاحتراق، وارتداء القفازات والنظارات الواقية، والتأكد من التهوية الكافية |
| أرقام تعريف الأمم المتحدة | UN1475 |
| رمز النظام المنسق | 2829.90.90 |
| فئة الخطر | 5.1 |
| مجموعة التعبئة | ثانيا |
| تسمم | قد يسبب تهيج الجلد والعينين والجهاز التنفسي. قد تكون ضارة إذا ما ابتلع |
طرق تصنيع كلورات المغنيسيوم
يمكن استخدام طرق مختلفة لتركيب Mg(ClO3)2.
الطريقة الشائعة هي تفاعل هيدروكسيد المغنيسيوم مع حمض الكلوريك. يستمر التفاعل على النحو التالي:
ملغم(OH)2 + 2HClO3 → ملغم(ClO3)2 + 2H2O
هناك طريقة أخرى وهي تفاعل كربونات المغنيسيوم مع حمض البيركلوريك. يستمر التفاعل على النحو التالي:
MgCO3 + 2HClO4 → Mg(ClO4)2 + CO2 + H2O
تتضمن الطريقة الثالثة التحليل الكهربائي لكلوريد المغنيسيوم في وجود ملح كلورات، مثل كلورات الصوديوم أو البوتاسيوم. يستمر التفاعل على النحو التالي:
2MgCl2 + 2NaClO3 → Mg(ClO3)2 + 2NaCl
في هذه الطريقة، تستخدم عملية التحليل الكهربائي أنود المغنيسيوم ويستخدم ملح الكلورات كعامل مؤكسد.
استخدامات كلورات المغنيسيوم
Mg(ClO3)2 له استخدامات مختلفة في مجالات مختلفة. وهذه بعض تطبيقاته:
- منتجات الألعاب النارية: تستخدم بشكل شائع كمادة مؤكسدة في تركيبات الألعاب النارية، مثل المشاعل والألعاب النارية وأجهزة الإشارة.
- التركيب الكيميائي: يستخدم كمصدر للأكسجين في تركيب المواد الكيميائية المختلفة، بما في ذلك الأدوية والأصباغ والمتفجرات.
- المبيض: يستخدم كعامل تبييض في إنتاج الورق واللب والمنسوجات.
- معالجة المياه: يستخدم أيضًا كعامل لمعالجة المياه لإزالة الشوائب والبكتيريا الموجودة في الماء.
- الكاشف المختبري: يستخدم ككاشف مختبري في طرق الكيمياء التحليلية المختلفة.
- الزراعة: يستخدم كسماد ومحسن للتربة لتوفير المغنيسيوم والأكسجين للنباتات.
- صناعة النفط والغاز: يستخدم كمادة مؤكسدة في عمليات الحفر والتفجير في صناعة النفط والغاز.
أسئلة:
س: ما هي صيغة كلورات المغنيسيوم؟
أ: ملغم(ClO3)2.
س: ما عدد الذرات الموجودة في 2.1 مول من Mg(ClO3)2؟
ج: يوجد 5.04 × 10^24 ذرة في 2.1 مول من Mg(ClO3)2.
س: ينقسم كلورات المغنيسيوم إلى ماذا؟
ج: يمكن أن يتحول Mg(ClO3)2 إلى كلوريد المغنيسيوم وغاز الأكسجين وغاز الكلور عند تسخينه.
س: كيف يتحلل كلورات المغنيسيوم؟
ج: يتحلل Mg(ClO3)2 إلى كلوريد المغنيسيوم وغاز الأكسجين عند تسخينه.
س: ما هو العدد الإجمالي لذرات الأكسجين الموجودة في وحدة واحدة من Mg(ClO3)2؟
ج: توجد 6 ذرات أكسجين في وحدة واحدة من Mg(ClO3)2.
س: إلى ماذا يتحلل Mg(ClO3)2؟
ج: يتحلل Mg(ClO3)2 لتكوين MgCl2 وO2 عند تسخينه.
س: ما هو العدد الإجمالي لذرات الأكسجين الموجودة في مول واحد من Mg(ClO3)2؟
ج: يوجد 6 مولات من ذرات الأكسجين في مول واحد من Mg(ClO3)2.
س: ما هي كتلة Mg(ClO3)2 بالجرام؟
ج: الكتلة الصيغةية بالجرام لـ Mg(ClO3)2 هي 232.21 جم/مول.
س: هل Mg(ClO3)2 أيوني أم جزيئي؟
ج: Mg(ClO3)2 مركب أيوني.
